微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分) 在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
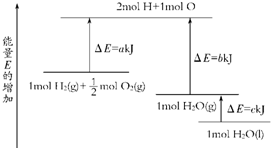
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
① kJ ② kJ ③ kJ
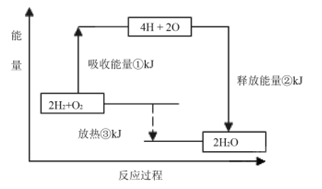
2、选择题 一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为( ? )