微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
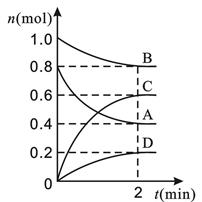
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
参考答案:(1)2A+B 本题解析:
本题解析:
试题分析:(1)根据所给信息分析,相同的时间内A减少了0.8-0.4=0.4摩尔,B减少了1.0-0.8=0.2摩尔,C增加了0.6-0=0.6摩尔,D增加了0.2-0=0.2摩尔,物质的量比等于化学方程式的系数比,所以AB为反应物,CD为生成物,方程式为:2A+B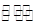 3C+D。(2)A的速率=(0.8-0.4)/0.5/2=0.4mol·(min·L)-1。(3)A、反应为前后气体的体积相等的反应,所以压强始终不变,所以压强不变不能说明反应已经达到平衡;B、由于反应中有非气体物质,所以混合气体的密度比不变说明反应达到平衡;C、消耗B和生成D都是说明正反应的速率,不能说明反应达到平衡;D、B的物质的量不变说明反应达到平衡。所以选BD。(4)平衡时A的浓度为0.4/0.5=0.8mol/L,B的浓度.8/0.5=1.6mol/L,C的浓度为0.6/.05=1.2mol/L,化学平衡常数=c(C)3/c(A)2c(B)=1.69。(5)A、只增加A的量,平衡正向移动,但A的转化率减小;B、移走一部分D,不影响平衡;C、升高温度,平衡正向移动,A的转化率增大;D、将体积缩小,平衡不移动。所以选C。
3C+D。(2)A的速率=(0.8-0.4)/0.5/2=0.4mol·(min·L)-1。(3)A、反应为前后气体的体积相等的反应,所以压强始终不变,所以压强不变不能说明反应已经达到平衡;B、由于反应中有非气体物质,所以混合气体的密度比不变说明反应达到平衡;C、消耗B和生成D都是说明正反应的速率,不能说明反应达到平衡;D、B的物质的量不变说明反应达到平衡。所以选BD。(4)平衡时A的浓度为0.4/0.5=0.8mol/L,B的浓度.8/0.5=1.6mol/L,C的浓度为0.6/.05=1.2mol/L,化学平衡常数=c(C)3/c(A)2c(B)=1.69。(5)A、只增加A的量,平衡正向移动,但A的转化率减小;B、移走一部分D,不影响平衡;C、升高温度,平衡正向移动,A的转化率增大;D、将体积缩小,平衡不移动。所以选C。
考点:化学平衡。
本题难度:困难
2、选择题 将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度的足量盐酸反应,则相应的曲线(图中虚线所示)正确的是?(???)。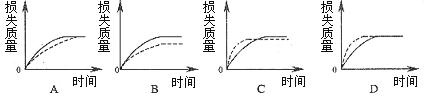
参考答案:D
本题解析:
试题分析:反应物的接触面积越大,反应速率越快,据此可知粉末状的碳酸钙与盐酸的反应速率快。由于碳酸钙的质量相同,所以答案选D。
点评:该题主要是考查学生对外界条件是如何影响反应速率的熟悉了解程度,旨在考查学生的答题能力,提高学生的逻辑思维能力和应试能力。
本题难度:一般
3、填空题 (6分)下图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象。(纵坐标为H2的生成速率)
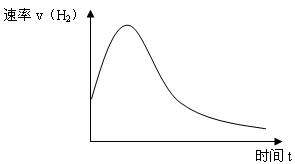
(1)反应前期速率加快的原因是: 。
(2)反应后期速率下降的原因是: 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是: 。
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
参考答案:
(1)该反应放热,随着反应进行,体系温度升高,因而反
本题解析:略
本题难度:一般
4、选择题 为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是
A.将铜片放入稀硫酸中,无现象。若再向所得的溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
B.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
参考答案:A
本题解析:
试题分析:A.将铜片放入稀硫酸中,无现象。若再向所得的溶液中加入硝酸银溶液,Cu与AgNO3溶液会发生置换反应,产生Ag和Cu(NO3)2,而不是过程原电池,反应原理有误,错误。B.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉由于与盐酸的接触面积增大,所以反应速率比块状的快,反应原理无误,正确;C.浓硝酸光照容易分解,所以将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解,反应原理无误,正确;D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,由于二氧化锰是氯酸钾分解的催化剂,因此产生氧气的速率加入少量二氧化锰的比没有加入的快,反应原理无误,正确。
考点:考查反应原理的正误判断的知识。
本题难度:一般
5、选择题 少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变产生H2的量,可以使用如下方法中的(???)
①加H2O??②加NaOH固体??③滴入几滴浓盐酸???④加CH3COONa固体??⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 0.1 mol/L的盐酸
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③⑥⑦⑧
参考答案:C
本题解析:
试题分析:影响反应速率的外界条件一般是温度、浓度、压强等。稀释降低氢离子的浓度,反应速率降低。加入氢氧化钠,消耗氢离子,降低氢离子的浓度,反应速率降低。滴入几滴浓硫酸,增大氢离子浓度,反应速率增大,铁不足,生成的氢气体积不变。加入醋酸钠固体,可以结合氢离子,降低氢离子的浓度,反应速率降低。由于随着反应的进行,氢离子又逐渐电离出来,生成氢气的体积不变。氯化钠溶液相当于是稀释,降低氢离子的浓度,反应速率降低。加入硫酸铜,铁置换出铜,构成原电池,加快反应速率,但消耗了铁,生成的氢气体积减少。升高温度,加
本题难度:一般