微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)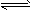 N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
[???? ]
A.不变
B.增大
C.减小
D.无法判断
2、填空题 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏,化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。 CCl4+H2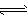 CHCl3 +HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
CHCl3 +HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。

①此反应在110℃时平衡常数为____。
②实验1中,CCl4的转化率A____50%(填“大于”、“小于”或“等于”)。
③实验2中,10h后达到平衡,H2的平均反应速率为____。在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,平衡将向___反应方向移动。
④实验3中,B的值___(选填序号)。
A.等于50%
B.大于50%
C.小于50%
D.从本题资料,无法判断
3、选择题 某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)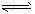 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。

请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是[???? ]
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol/L
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1] 比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
4、填空题 合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题: ???
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为__________________L。
(2)合成气在合成氨气时需除去CO,可利用以下反应:CO(g)+H2O(g) CO2(g)+H2(g)???
CO2(g)+H2(g)???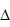 H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为____________??(保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH-?的物质的量浓度为___________,碳酸氢钾溶液中离子浓度大小顺序为?____________
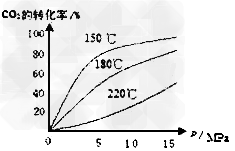
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应 H?__________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。
H?__________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。
5、选择题 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)下列叙述正确的是 [???? ]
4NO(g)+6H2O(g)下列叙述正确的是 [???? ]
A.达到化学平衡时,4v正(O2) =5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) =3v正(H2O)