微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实现Al3++3 +6H2O=4Al(OH)3↓,正确的做法是
+6H2O=4Al(OH)3↓,正确的做法是
A.向铝盐溶液中不断加入纯碱溶液
B.向铝盐溶液中不断加入小苏打溶液
C.向烧碱溶液中不断滴入铝盐溶液
D.向铝盐溶液中不断滴入烧碱溶液
参考答案:C
本题解析:A、B中都是水解相互促进,生成物是氢氧化铝和CO2;D中先生成氢氧化铝沉淀,当氢氧化钠过量时,再溶解生成偏铝酸钠,所以正确的答案选C。
本题难度:一般
2、选择题 硫酸镁和硫酸铝的混合溶液中,Al3+的浓度为0.2 mol·L-1,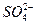 的浓度为0.4 mol·L-1,则混合溶液中Mg2+物质的量浓度为(???)
的浓度为0.4 mol·L-1,则混合溶液中Mg2+物质的量浓度为(???)
A.0.4 mol·L-1
B.0.3 mol·L-1
C.0.2 mol·L-1
D.0.1 mol·L-1
参考答案:D
本题解析:根据电荷守恒规律:3c(Al3+)+c(Na+)=2c(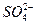 ),将已知条件代入后即得解。
),将已知条件代入后即得解。
本题难度:一般
3、填空题 明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示:
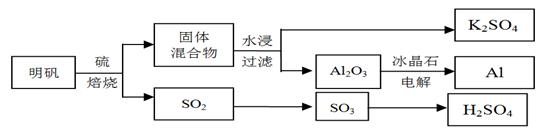
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O + 3S = 2K2SO4 + 2Al2O3 + 9SO2 + 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是???????。
(2)从水浸后的滤液中得到K2SO4晶体的方法是???????。
(3)Al2O3在一定条件下可制得AlN,其晶体结构如图所示,该晶体中Al的配位数是???????。

(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是???????。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+ O2(g) 2SO3(g)??????????△H1 = -197 kJ /mol;
2SO3(g)??????????△H1 = -197 kJ /mol;
H2O(g) H2O(l)???????????????????△H2 = -44 kJ/mol;
H2O(l)???????????????????△H2 = -44 kJ/mol;
2SO2(g)+ O2(g)+ 2H2O(g)=2H2SO4(aq) △H3 = -545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是???????????。
焙烧948 t明矾(M =" 474" g/mol),若SO2的利用率为96%,可产生质量分数为98%的硫酸?????t。
参考答案:(1)S (2分)
(2)蒸发结晶(2分)
(3
本题解析:
试题分析:本题氧化还原反应、物质的分离和提纯、物质的结构等知识点融合到工艺过程中,还考查了原电池原理及热化学方程式的书写,难度适中。
本题难度:一般
4、填空题 某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是?????。
⑵AlO(OH)与NaOH反应的化学方程式为?????。
⑶在稀释、结晶过程中:稀释的目的是?????;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的?????气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:?????。
⑸该生产流程能实现?????(填化学式)的循环利用。
参考答案:
⑴加快反应的速率
⑵AlO(OH) +NaOH
本题解析:
试题分析:(1)高温有利于加快反应速率;(2)AlO(OH)与NaOH反应的同样应是偏铝酸钠,AlO(OH) +NaOH=NaAlO2+H2O;(3)该过程是通过NaAlO2的稀释生成Al(OH)3,没有其它反应物,故其应该是水解产生,稀释促进NaAlO2的水解,也可以用CO2与其反应利用强酸制弱酸生成氢氧化铝;(4)加入熟石灰生成碳酸钙除去;(5)NaOH碱浸时使用,最后过滤时产生,故是循环利用。
本题难度:一般
5、选择题 取质量相等的两份铝屑,一份与100mL? 1 mol·L-1 HCl反应,另一份与100mL? 1 mol·L-1 NaOH溶液充分反应,产生的H2体积比为1:2(相同条件),则每份铝屑的质量为( )????????????????????
A.0.9g
B.2.7g
C.1.8 g
D.无法计算
参考答案:C
本题解析:
试题分析:铝和HCl反应的关系式为Al~3HCl~3/2H2,铝和NaOH反应的关系式为Al~NaOH~3/2H2,可以得知,Al生成H2的量是固定的,产生的H2体积比为1:2,NaOH溶液过量,Al的物质的量为2/3mol,即1.8 g。
故选C。
点评:本题考查化学方程式的计算,难度不大,关键是要正确书写反应的有关方程式,注意题中盐酸和NaOH足量这一点.本解法利用电子转移守恒来计算解答,关键清楚反应实质。
本题难度:一般