微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 &n bsp;一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体???????②H2O ③NH4Cl固体
④CH3COONa固体 ??⑤NaNO3固体????? ⑥KCl溶液
A.②④⑥
B.①②
C.②③⑤
D.②④⑤⑥
参考答案:A
本题解析:
试题分析:加入氢氧化钠会影响氢气的总量;加水降低氢离子浓度,减缓反应速率,可以;加入氯化铵不能降低氢离子浓度;加入醋酸钠可以降低氢离子浓度,同时不减少氢气的总量,可以;加入硝酸钠,产生的就不是氢气而是一氧化氮,不行;加入氯化钾溶液相当于加水,可以。故选②④⑥
点评:要综合考虑盐酸中加入的物质是否对生成氢气有影响。属于较简单题。
本题难度:一般
2、填空题 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
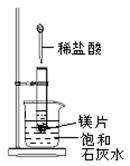
(1)(3分)实验中观察到的现象是__________________________
(2)(3分)产生上述现象的原因是_______________;
(3)(2分)写出有关的离子方程式:_______________________。
(4)(2分)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)①镁片上有大量气泡产生②镁片逐渐溶解③烧杯中溶液变混浊
本题解析:在金属活动顺序表中镁位于氢的前面,和酸反应能置换出氢气。金属和酸的反应一般是放热反应,所以饱和石灰水的温度要升高,但氢氧化钙的溶解度随温度的升高而降低,所以会有晶体析出。反应放热,说明反应物的总能量高于生成物的总能量。
本题难度:一般
3、选择题 下列对化学反应速率影响因素的分析错误的是( )
A.一定浓度稀硫酸与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量K2SO4溶液
B.NO+CO2

NO2+CO在密闭容器中进行,压强不变充入N2使体积增大,反应速率不变
C.升高温度时,化学反应速率加快,主要是由于反应物分子的能量增加,活化分子百分数增大,有效
碰撞次数增多,化学反应速率加快
D.催化剂能改变化学反应速率且参与反应,但催化剂在化学反应前后,化学性质和质量都不变
参考答案:A、锌和酸的反应中,向反应物中加入适量K2SO4溶液相当于加
本题解析:
本题难度:一般
4、填空题 “硫?碘”循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;?
Ⅱ.2HI H2+I2;??
H2+I2;??
Ⅲ.?2H2SO4 2SO2+O2+2H2O
2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(单选)。
a.反应Ⅲ是在常温下进行????????????b.反应Ⅰ中SO2氧化性比I2强
c.循环过程中需补充H2O????????????d.循环过程产生1?mol?O2的同时产生1?mol?H2
(2)一定温度下,向1?L密闭容器中加入1?mol?HI(g),发生反应Ⅱ, H2物质的量随时间的变化如图所示。0~2?min内的平均反应速率 v(HI)=________。该温度下,Ⅱ的逆反应?H2(g)+I2(g) 2HI(g) 的平衡常数K=________。
2HI(g) 的平衡常数K=________。
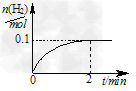
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右” 或“不”),若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3???????b.CuSO4????????c.Na2SO4????????d.NaHCO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572?kJ/mol 某氢氧燃料电池释放228.8?kJ电能时,生成1?mol液态水,该电池的能量转化率为________。
参考答案:(1)c
(2)0.1 mol/(L·min);64<
本题解析:
本题难度:一般
5、实验题 某研究性学习小组设计了如下二组实验:
(I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。
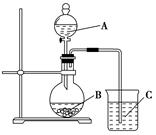
设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:
A: ,B: ,C: 。
(2)写出烧杯中发生反应的离子方程式: 。
(Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3溶液改成物质的量浓度为 mol/L的Fe2(SO4)3溶液。
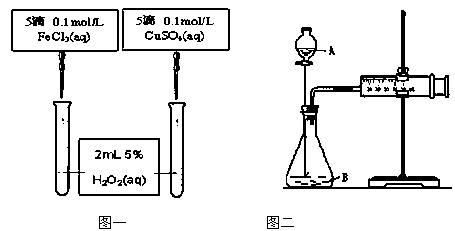
(2)检查图二装置气密性的方法是 ;
图二所示实验中需测量的数据是 。
参考答案:(I) (1)HNO3 CaCO3
本题解析:实验验证元素周期律中, 非金属元素的非金属性越强,非金属性C>Si ,
CO2+SiO+H2O===H2SiO3↓+CO.强酸制弱酸,碳酸的酸性强于硅酸。
比较Fe3+和Cu2+对H2O2的催化效果,看反应产生气泡快慢(或反应完成的先后或试管壁的冷热程度);
本题难度:困难