微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了进一步研究硫酸铜的量对氢气生成速率的影响,某同学设计了如表一系列实验。将表中所给的试剂按一定体积混合后,分别加入四个盛有过量Zn粒的反应瓶(甲、乙、丙、丁)中,收集产生的气体,记录收集相同体积的气体所需时间。
实验
试剂/mL
| 甲
| 乙
| 丙
| 丁
|
4 mol/L H2SO4
| 20
| V1
| V2
| V3
|
饱和CuSO4溶液
| 0
| 2.5
| V4
| 10
|
H2O
| V5
| V6
| 8
| 0
?
下列说法正确的是?????? ( )
A.实验甲产生气泡的速率最快? B.V1<V2<V3<20
C.V4=V5=10? ??????????????????????????????? D.V6=7.5
参考答案:D
本题解析:加入硫酸铜主要通过反应形成Zn|H2SO4(aq)|Cu原电池,从而使反应速率加快,A错误;根据信息可知,只考虑硫酸铜的量,而不考虑硫酸的浓度,所以应使每组实验最终溶液中硫酸的浓度一致,为了实验的简单化,可取同量的硫酸,而硫酸铜和水的体积之和相同,即V1=V2=V3=20,B项错误;由丁组知硫酸铜和水的体积之和为10 mL,所以V4=2、V5=10,C错误;V6=7.5,D正确。
本题难度:一般
2、选择题 少量铁粉与100ml0.01mol/L稀盐酸反应。为了加快速率而不改变H2产量,可以使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加NaCl溶液 ⑤滴加几滴硫酸铜溶液 ⑥适当升高温度(不考虑盐酸挥发) ⑦改用10ml 0.1mol/L的盐酸
A.③⑤⑥⑦
B.③⑥⑦
C.③④⑤⑥⑦
D.①③⑤⑦
参考答案:B
本题解析:
试题分析:①加水,稀释了盐酸的浓度,反应速率变慢;②加入氢氧化钠与盐酸反应,减少了盐酸的浓度,反应速率变慢;③加浓盐酸,反应速率加快;④加氯化钠溶液,相当于稀释盐酸浓度,反应速率变慢;⑤滴加硫酸铜溶液,铁把铜置换出来,形成原电池,反应速率加快,但与盐酸反应的铁减少,减少了产生氢气的量;⑥升高温度,反应速率加快;⑦改用浓度大的盐酸,反应速率加快,选B。
考点:考查化学反应速率的影响因素。
本题难度:一般
3、简答题 某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去).
正确操作,记录得到下图2中部分实验数据.
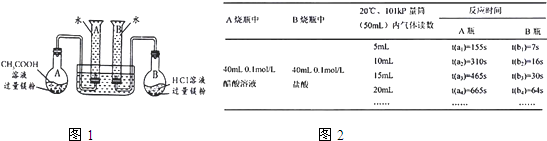
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于______;
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是______;
(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:______;
②由______[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸,不存在电离平衡;由______[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.
(4)该实验得到什么结论?(回答出两点即可)
①______;
②______.
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入______(填写两种不同作用原理的物质).
参考答案:(1)在装置中,A、B两个量筒口用胶塞密封,这样反应产生的H
本题解析:
本题难度:一般
4、实验题 (12分)控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙
状态
| C(HCl)/ mol·l-1
| 溶液温度/℃
| 碳酸钙消失
时间/s
| 反应前
| 反应后
| 1
| 块状
| 0.5
| 20
| 39
| 400
| 2
| 粉末
| 0.5
| 20
| 40
| 60
| 3
| 块状
| 0.6
| 20
| 41
| 280
| 4
| 粉末
| 0.8
| 20
| 40
| 30
| 5
| 块状
| 1.0
| 20
| 40
| 120
| 6
| 块状
| 1.0
| 30
| 50
| 40
|
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)实验5、6表明 对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有 ,能表明这
一规律的实验序号是 。
参考答案:(1) 放热 &
本题解析:(1)反应后溶液的无毒升高,说明反应是放热反应。
(2)实验5、6不同的是温度,因此探究的是温度对反应速率的影响。
(3)根据反应中的变量可知,不同的还有反应物的接触面积,因此影响化学反应速率的因素还有反应物接触面积,对应的实验是1、2。
本题难度:一般
5、选择题 某学习小组为了探究?BrO3-+5Br-+6H+=3Br2+3H2O?反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号
相关数据 | ① | ② | ③ | ④ | ⑤
c(H+)/mol?L-1
0.008
0.008
0.004
0.008
0.004
c(BrO3-)/mol?L-1
0.001
0.001
0.001
0.002
0.002
c(Br-)/mol?L-1
0.10
0.20
0.20
0.10
0.40
v/mol?L-1?s-1
2.4×10-8
4.8×10-8
1.2×10-8
4.8×10-8
v1
下列结论不正确的是( )
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v=k?ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=2
D.实验⑤中,v1=4.8×10-8mol?L-1?s-1
参考答案:A、由于温度升高,反应速率增大,故A正确;
B、实验②
本题解析:
本题难度:简单
|
|