微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (11分)过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验。
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是?????????????????????;
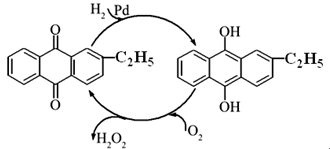
(2)?资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是??????????????????????????????????。
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号
| T/℃
| H2O2初始浓度/
mol·L-1
| FeCl3初始浓度/
mol·L-1
|
Ⅰ
| 20
| 1.0
| ?
|
Ⅱ
| 50
| 1.0
| 0
|
Ⅲ
| 50
| ?
| 0.1
①实验Ⅰ、Ⅱ研究温度对分解速率的影响,则实验Ⅰ中FeCl3初始浓度应为?????mol·L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为???mol·L-1。
②三组实验中分解速率最快的是???????????????(填编号)。
Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+?=2Mn2++8H2O+?5O2
(4)滴定到达终点的现象是__________________________________________________。
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
?
| 第一次
| 第二次
| 第三次
| 第四次
| 体积(mL)
| 17.10
| 18.10
| 18.00
| 17.90
计算试样中过氧化氢的浓度为????????????????????mol·L-1。
(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果??????(“偏高”或“偏低”或“不变”)。
参考答案:⑴过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键(1
本题解析:略
本题难度:一般
2、实验题 某学生为验证苯酚、醋酸、碳酸的酸性强弱,经过慎重考虑,设计如下实验装置:请回答下列问题
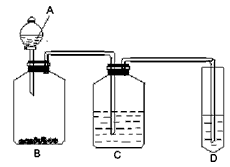
(1)各仪器中所盛放的药品是A______C______D______,(将序号填入横线上 ①苯酚 ②醋酸 ③碳酸
④Na2CO3 ⑤NaHCO3 ⑥苯酚钠)
(2) 装置C的作用____________。
(3) 试描述能证明三种酸的酸性强弱的现象____________。
(4)写出装置D中发生反应的化学方程式__________________。
参考答案:(1)②;⑤;⑥
(2)除去CO2中的氯化氢
本题解析:
本题难度:一般
3、实验题 以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?_______(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为______________。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为_____________________。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量______
(填字母) ,仍然无法观察到沉淀产生。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式_____________________。
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_______极,其电极反应式为
______________;电池的总反应式______________。
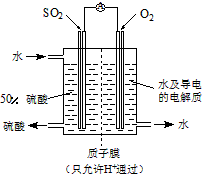
参考答案:(1)①相同;2SO2+O2![]() 本题解析: 本题解析:
本题难度:一般
4、实验题 某化学研究性学习小组的同学在学习了NH3的性质时讨论:运用类比的思想,既然NH3具有还原性,能否像H2那样还原CuO呢?他们设计实验制取NH3并探究上述问题。请你参与该小组的活动并完成下列研究:
(1)制取NH3
①写出实验制取NH3的化学方程式????????????????????????????????;
②在实验室中,还可以用浓氨水与??????????(填写一种试剂)快速制取少量NH3;
③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和NH4Cl溶液的方法收集NH3。你认为他能否达到目的???????????(填“能”或“否”)。
(2)该小组中某同学设计了下图所示的实验装置(夹持未画出),探究NH3的还原性:
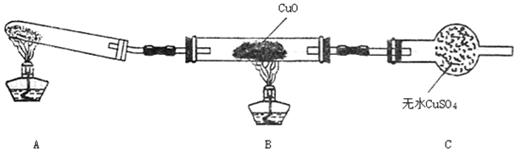
①该装置在设计上有一定缺陷,对该装置的改进措施是:
______________________________________________________________________
____________________________________________________________________。
②利用改进后的装置进行实验,充分反应后,观察到CuO全部变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出NH3与CuO反应的化学方程式???????????????????????????????????????????????。
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ = Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
?????????????????????????????????????????????????????????????。
参考答案:(1)①2NH4Cl + Ca(OH)2 本题解析:略 本题解析:略
本题难度:一般
5、选择题 只用一种试剂,就可将AgNO3、KSCN、稀H2SO4、NaOH四种溶液一次性区分开,这种试剂是( )
A.FeCl3溶液
B.CuSO4溶液
C.BaCl2溶液
D.Na2CO3溶液
参考答案:A.FeCl3溶液加入四种溶液中依次出现的现象是:白色沉淀、
本题解析:
本题难度:一般
|
|