微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
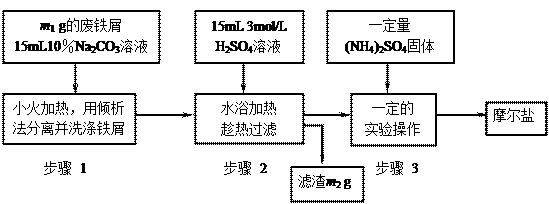
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:????????????????????? ▲???????????????????????。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有???? ▲????:
A.沉淀的颗粒较大???? B.沉淀容易沉降???? C.沉淀呈胶状??? D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示):????????▲???????。步骤2中溶液趁热过滤的原因是??????????? ▲???????????。
中铁屑过量的目的是(用离子方程式表示):????????▲???????。步骤2中溶液趁热过滤的原因是??????????? ▲???????????。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到???? ▲???????时,停止加热。需经过的实验操作包括:?? ▲?????、 ▲ 、减压过滤(或抽滤)等得到较为??????? ▲??????????的晶体。
加热到???? ▲???????时,停止加热。需经过的实验操作包括:?? ▲?????、 ▲ 、减压过滤(或抽滤)等得到较为??????? ▲??????????的晶体。
(5)抽滤装置的仪器有:?? ▲?????、?? ▲?????、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
???Fe2++???MnO4-+(??????? )="?" ??Mn2++?????Fe3++????H2O
②本实验的指示剂??? ▲??????????。
A.酚酞??? B.甲基橙?? C.石蕊?? D.不需要
③KMnO4溶液置于??? ▲?????? (酸式、碱式)滴定管中
④终点颜色的变化:????????? ▲???????????????????????????。
⑤产品中Fe2+的质量分数为??? ▲??????。
 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:???? ▲???????。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:???? ▲???????。(用a,b,c回答)
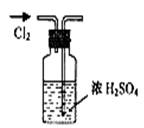
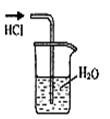
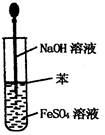
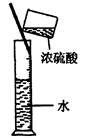
2、选择题 实验是研究化学的基础,下图所示的实验方法、装置或操作完全正确的是
 ???
??? ??
??
A.干燥Cl2
B.吸收NH3
C.制取Fe(OH)2沉淀
D.稀释浓H2SO4
3、选择题 a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且a、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应.下列推理不正确的是( )
A.a一定为KOH溶液
B.b一定为KHSO4溶液
C.c一定为AlCl3溶液
D.e一定为MgCl2溶液
4、填空题 测定海水中溶解氧的步骤如下:
(1)水样的固定。取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应。
(2)酸化。开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞。反复振荡至沉淀完全溶解。
(3)滴定。向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2+ +O2 + 4OH- = 2MnO(OH)2??(该反应极快)?
MnO(OH)2 +2I- + 4H+ = Mn2+ + I2 + 3H2O
I2 + 2S2O32- = 2I- + S4O62-???请回答下列问题:
(1)在进行(1)、(2)操作时,要注意“迅速”,如果操作缓慢,会使测定结果?????(填“偏高”或“偏低”或“无影响”)原因是?????????????????????????????????。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果??????(填“偏高”或“偏低”或“无影响”)原因是?????????????????????????????????。
(3)滴定前,未排除滴定管中的气泡。在滴定过程中气泡的排除,会使测定结果???(填“偏高”或“偏低”或“无影响”)原因是?????????????????????????????????。
5、简答题 某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧.其实验装置图如图所示:
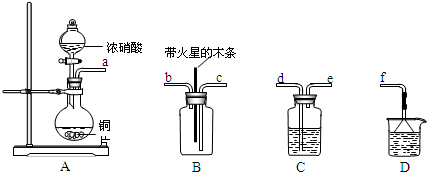
(1)按气流方向连接各仪器接口,顺序为a→______→______→______→______→f.
装置C、装置D的作用分别是______、______.
(2)实验开始后,能证明二氧化氮支持燃烧的实验现象是:______.
(3)等物质的量的二氧化氮和碳反应,生成两种气体物质,且其物质的量之比为1:1.该反应的化学方程式为:______.