微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中微粒的物质的量浓度关系正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(N H4+)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-)
2、选择题 已知0.02 mol/L-1CH3COOH溶液和0.01 mol /L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的[???? ]
A.c (CH3COO-)>c (Na+)??
B.c (Na+) + c (H+) =c (OH-) +c (CH3COOH)+c (CH3COO-)
C.c (CH3COOH)>c (CH3COO-)??
D.c (CH3COOH)+c (CH3COO-)=0.02 mol/L-1
3、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
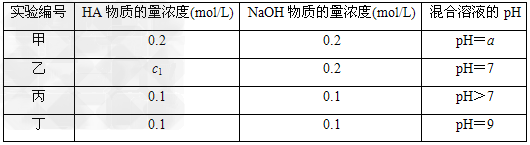
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_________________________________________________.
(2)不考虑其他组的实验结果,单从乙组情况分析,c1________等于0.2?mol/L(“一定”或“不一定”).混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________(填字母序号).
A.前者大?? B.后者大 C.二者相等?? D.无法判断
(3)从丙组实验结果分析,HA是________酸(“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是___________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________?mol/L.写出该混合溶液中c(Na+)-c(A-)=________?mol/L的精确结果(不能做近似计算,回答准确值,结果不一定要化简).
4、填空题 (1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
?
+4
)+c(NH3?H2O)一定等于______
②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.
5、选择题 25℃时,在0.1mol?L-1的下列溶液中,微粒的物质的量浓度关系正确的是( )
A.NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.CH3COONa溶液中:c(CH3COOH)+c(H+)=c(OH-)
D.Na2CO3溶液中:2c(Na+)=c(CO32- )+c(HCO3- )+c(H2CO3)