微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)

(1)A、B、C、D四种元素电负性由大到小排列顺序为??????????????????????????????
(2)C形成的晶体中,其微粒堆积方式为??????????;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为:?????????????????????????????????????;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为?????????????。
(4)E核外电子排布式是????????????????????????????????,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有????????????????????????????????????
参考答案:(1)N ﹥ C ﹥ Si ﹥ Na
(2)体心立方堆
本题解析:
A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,A为碳,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外),B为氮,C为钠,D为硅,又E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满,E为铜。
(1)A、B、C、D四种元素电负性由大到小排列顺序为N ﹥ C ﹥ Si ﹥ Na
(2)C形成的晶体是钠,其微粒堆积方式为体心立方堆积。
(3)Si + 2OH-+H2O ="=" SiO32-+ 2H2↑
本题难度:一般
2、填空题 我国已研制出一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为???????。
(2)S与O为同主族元素,其中电负性较大的是???????;H2S分子中S原子杂化轨道类型为???????;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:???????????。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体????????(填“能”或“否”)。
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为???????;欲比较CaO与NaCl的晶格能大小,需考虑的数据是???????。
参考答案:(1)3d54s2
(2)O sp3 H2SO4的非羟
本题解析:(1)Mn位于周期表第四周期第ⅦB族,其基态价层电子排布式为3d54s2。(2)O的电负性较大;H2S中心原子S上有两对孤电子对,H2S分子中S原子杂化轨道类型为sp3杂化;H2SO3和H2SO4可表示成(HO)2SO和(HO)2SO2,H2SO4的非羟基氧原子数目大于H2SO3,故H2SO4的酸性大于H2SO3的酸性。(3)①由于H2N—NH2中的氮原子上有孤电子对可以作为配体和其他离子形成配合物。②由NaCl的晶胞结构可知一个CaO晶胞中含有4个Ca2+;晶格能的大小与离子半径和离子所带的电荷数有关。
本题难度:一般
3、选择题 下列说法中,正确的是[???? ]
A.由分子构成的物质中一定含有共价键
B.形成共价键中不一定是非金属元素
C.正四面体结构的分子中的键角一定是109°28′
D.不同的原子的化学性质可能相同
参考答案:D
本题解析:
本题难度:一般
4、填空题 ( 13分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
??分子式
| 结构简式
| 外观
| 熔点
| 溶解性
|
C12H10ClN3O
| 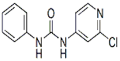
| 白色结晶粉末
| 170~172°C
| 易溶于水
(1)氯元素基态原子核外电子的未成对电子数为?????????。
(2)氯吡苯脲的晶体类型为_______????????,所含第二周期元素第一电离能从大到小的顺序为________________。
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为______????_。
(4)氯吡苯脲晶体中,微粒间的作用力类型有________????_。
A.离子键B.金属键C.共价键D.配位键E.氢键
(5)氯吡苯脲熔点低,易溶于水的原因分别为_________________________________
________________________________________________________________________。
(6)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
 异氰酸苯酯???????????????? 2-氯-4-氨基吡啶???????????????氯吡苯脲 异氰酸苯酯???????????????? 2-氯-4-氨基吡啶???????????????氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键
参考答案:(13分)(1)1?(1分)??(2)分子晶体?? N>
本题解析:
试题分析:(1)根据构造原理可知,氯元素基态原子核外电子的排布式是1s22s22p63s23p5,所以未成对电子数为1个。
(2)氯吡苯脲的熔点较低,易溶于水,所以其晶体类型是分子晶体。其中所含第二周期元素分别是C、N、O,非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的,即正确的顺序是N>O>C。
(3)根据结构简式可知,2个氮原子全部形成单键,属于sp3杂化。另外一个氮原子形成双键,所以是sp2杂化。
(4)氯吡苯脲
本题难度:一般
5、选择题 下列各说法中正确的是[???? ]
A.分子中键能越大,键长越大,则分子越稳定
B.元素周期表中的IA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO-H,分子中键角为180°
D.H-O键能为463kJ/mol,即18g H2O分解成H2和O2时,需消耗能量为2×463kJ
参考答案:B
本题解析:
本题难度:简单
|