微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
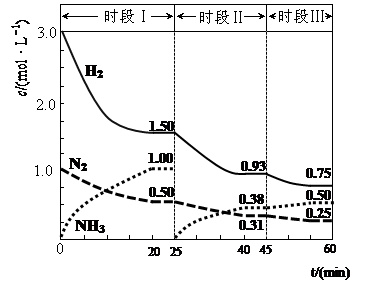
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
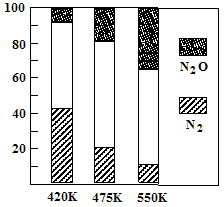
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
参考答案:(16分)有效数字错误或无单位扣1分
(1)①0.05
本题解析:
试题分析:(1)①读图可知,前20min内氨气的浓度由0逐渐增大到1.0mol/L,根据定义式可得,v(NH3)=1.0mol/L÷20min=0.050mol/(L?min),注意保留两位有效数字;氮气由1.0mol/L逐渐减小到0.50mol/L,根据c?V=n可求参加反应的氮气的物质的量,即(1.0—0.50)mol/L1L=0.50mol,由于N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
考点:考查化学反应原理,涉及平均反应速率的计算、根据反应物或生成物的变化量计算反应过程中放出的热量、根据反应速率和化学平衡图像判断改变的外界条件、指定阶段下平衡常数的计算表达式、从图中得出温度对平衡移动的影响规律、解释原因、燃料电池的负极反应式等。
本题难度:困难
2、选择题 下列叙述中不正确的是
①电子从原电池正极经导线流向负极
②电子从原电池负极经导线流向正极
③原电池中电子从发生氧化反应的电极流出
④原电池中电子从发生还原反应的电极流出
⑤原电池中的两个电极,相对活泼的金属是负极
A.①③
B.②④
C.①④
D.②③⑤
参考答案:C
本题解析:
本题难度:简单
3、选择题 目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是
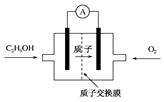
A.通入乙醇的电极为该电池的正极
B.放电过程中,电源内部的H+从正极区向负极区迁移
C.该电池的正极反应为:4H++O2+4e—=2H2O
D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L
参考答案:C
本题解析:
试题分析:乙醇作为一种燃料,在反应中失去电子,被氧化,因此在燃料电池中乙醇在负极上发生反应,A错误;负极失去电子,电子沿导线传递到正极上,因此溶液中的阳离子向正极移动,阴离子向负极移动B错误;氧气在正极反应,C正确;乙醇中碳原子的化合价是+2价,而在产物中碳原子的化合价是+4价,即1个碳原子失去6个电子,所以1mol乙醇转移12mol电子,消耗0.2mol乙醇转移2.4mol电子,电解池的阴极生成氢气,生成氢气的物质的量为x,根据转移电子数守恒,2x=2.4mol,x=1.2mol,故生成氢气的体积为1.2molx22.4L/mol=26.88L,D错误,答案选C.
考点:电解池和原电池原理
本题难度:困难
4、简答题 (14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①该反应平衡常数表达式____________________________
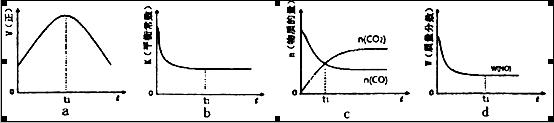
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol????????①
2NO2(g)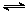 N2O4(g)??△H=-56.9 kJ/mol?????????②
N2O4(g)??△H=-56.9 kJ/mol?????????②
H2O(g)=H2O(l)???△H=-44.0 kJ/mol????????????③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L
参考答案:(14分)
(1)①K=c2(CO
本题解析:
试题分析:(1)①根据化学平衡常数的定义得该反应的K= c2(CO2)·c(N2)
c2(NO)c2(CO)
②图a中t1时刻说明正反应速率最大,因为该反应为放热反应,容器为绝热容器,所以开始时相当于给体系升温,温度升高,反应速率加快,但同时升温不利于正反应的进行,所以正反应速率后来又逐渐减小,当正反应速率不再变化时说明达平衡状态,因此t1时刻未达到平衡状态;b图,因为该反应为放热反应,容器为绝热容器,所以开始时相当
本题难度:一般
5、选择题 我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi  LixV2O5。下列说法中,正确的是???(????)
LixV2O5。下列说法中,正确的是???(????)
A.锂在放电时做正极材料,充电时为阳极材料
B.电池在放电时,Li+向负极移动
C.该电池充电时阳极的反应为:LixV2O5 -xe-=V2O5 + xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
参考答案:C
本题解析:
试题分析:放电时锂做负极,充电时锂是阴极,A错误;放电时,阳离子向正极移动,B错误;充电时阳极发生氧化反应,C正确;V2O5在反应中有化合价的变化,所以不能做反应的载体,D错误。答案选C。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子
本题难度:简单