四种金属活动性由强到弱的顺序:______
参考答案:①B棒上有气泡发生,说明B棒上发生还原反应生成氢气,则B棒为
本题解析:
本题难度:一般
2、选择题 在理论上不能用于设计原电池的化学反应是
A.2FeCl3(aq)+2KI(aq) = 2FeCl2(aq)+2KCl(aq)+I2(aq) △H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3·H2O(aq)+8H2O(1) △H >0
C.4Al(s)+ 6H2O(1)+ 3O2(g)==4Al(OH)3(s) △H <0
D.Zn(s)+2MnO2(s)+2H2O(1) = 2MnOOH(s) +Zn(OH)2(s) △H <0
参考答案:B
本题解析:
试题分析:原电池的形成条件之一是有自发的氧化还原反应发生,而自发的氧化还原反应是放热反应,所以吸热反应不是自发的反应,答案选B。
考点:考查原电池的形成条件
本题难度:一般
3、选择题 下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
A.
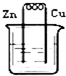
B.

C.
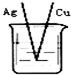
D.
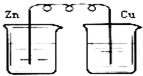
参考答案:A、该装置构成原电池,铜作正极,正极上氢离子得电子生成氢气,
本题解析:
本题难度:简单
4、填空题 由A、B、C、D四种金属按下表中装置进行实验。
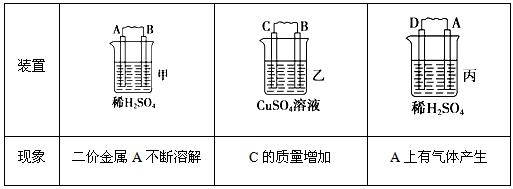
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是__________________________。
(2)装置乙中正极的电极反应式是__________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是__________________。
参考答案:(1)A-2e-→A2+
(2)Cu2++2e-→C
本题解析:
本题难度:一般
5、填空题 (13分)直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2 O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H ="-241.8" kJ·mol-1 O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= 。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),该极发生的电极反应为 。

(4)已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:
N2 (g)+ 3H2 (g)= 2NH3(g) ΔH=" —92.4" KJ/mol,则N≡N键的键能是 。
参考答案:(13分)(1)CH3OH(l) + 3/2 O2(g) =
本题解析:
试题分析:(1)根据已知条件可知,甲醇燃烧的热化学方程式为CH3OH(l) + 3/2 O2(g) = CO2(g) + 2H2O(l) △H =-726.51 kJ/mol。
(2)根据盖斯定律可知,②-①即得到H2(g)+ O2(g)=H2O(g),所以该反应的△H=△H2-49.0 kJ·mol-1=-241.8 kJ·mol-1,解得△H2=-192.8 kJ·mol-1 。 O2(g)=H2O(g),所以该反应的△H=△H2-49.0 kJ·mol-1=-241.8 kJ·mol-1,解得△H2=-192.8 kJ·mol-1 。
(3)原电池中负极失去电子,正极得到电子。所以甲醇在负极通入。由于含有氢离子交换膜,因此负极电极反应式是CH3OH+ H2O-6e-=CO2 + 6H+。
(4)反应热等于反应物中化学键的断裂吸收的能量和形成化学键时所放出的能量的差值。因此根据键能可知,ΔH=x+2×436kJ/mol-2×3×391kJ/mol=—92.4 KJ/mol,解得x=945.6KJ/mol,即氮氮三键键能是945.6KJ/mol。
考点:考查热化学方程式、电极反应式的书写、依据反应热的有关计算等
点评:在计算反应热时除根据盖斯定律外,还可以利用键能进行计算。因为化学反应的实质就是旧键断裂。新键形成的过程。
本题难度:困难
|