微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验试剂:水、试剂X的溶液等
(2)实验过程:
 [
[
根据上述实验步骤回答下列有关问题:
①试剂X是?????????,其作用是???????????????????????????????。
②操作(1)所需要的玻璃仪器有???????????????????????????????????????????????。
③操作(2)的名称 是????????????????。
是????????????????。
④通过计算判断该味精中NaCl的质量分数,是否符合其包装上标注的标准??????????。
⑤如果溶液A为50 mL,则溶液A中NaCl的物质的量浓度是多少?
参考答案:(10分)① AgNO3溶液(1分)????沉淀NaCl中的
本题解析:略
本题难度:一般
2、选择题 把NaHCO3和Na2CO3·10H2O混合物6.56g溶于水制成100mL溶液,测得溶液中钠离子的浓度为0.5mol/L。向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为(???? )
A.2.93 g
B.5.85 g
C.6.56g
D.无法确定
参考答案:A
本题解析:钠离子的物质的量为0.05mol,向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体为氯化钠,且物质的量为0.05mol,质量约为2.93 g。
本题难度:一般
3、计算题 将m g固体NaHCO3加热分解一段时间后,质量变为n g。试求:
(1)尚未分解的NaHCO3的质量;
(2)生成的Na2CO3的质量;
(3)NaHCO3完全分解时的n值。
参考答案:(1) 本题解析:本题可用“差量法”解题。反应前固体为NaHCO3,反应后为未反应的NaHCO3和反应生成的Na2CO3的混合物。因此找到反应物Na2CO3和反应前后固体质量差对应的正比例关系即可迅速解题。
本题解析:本题可用“差量法”解题。反应前固体为NaHCO3,反应后为未反应的NaHCO3和反应生成的Na2CO3的混合物。因此找到反应物Na2CO3和反应前后固体质量差对应的正比例关系即可迅速解题。
(1)2NaHCO3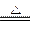 Na2CO3+H2O↑+CO2↑ Δm
Na2CO3+H2O↑+CO2↑ Δm
168 g??????? 106 g??????
本题难度:简单
4、选择题 将106 g的Na2CO3和84 g NaHCO3先经充分强热后,再分别足量的盐酸反应,下列说法错误的是( )
A.消耗盐酸一样多
B.放出CO2的总量一样多
C.后者生成的NaCl是前者的一半
D.后者消耗盐酸是前者的一半
参考答案:A
本题解析:
试题分析:106 g的Na2CO3和84 g NaHCO3的物质的量均为1mol,因此产生的二氧化碳气体均为1mol;而生成的NaCl的物质的量前者是后者的两倍;消耗的盐酸前者是后者的两倍;因此A说法错误。故答案选A。2CO3和NaHCO3的性质
点评:考查Na2CO3和NaHCO3的性质,属于基础题,掌握课本基础即可解答,属于送分题。
本题难度:简单
5、计算题 钠原子最外层只有一个电子,在反应中失去最外层电子形成+1价的Na+,为了验证钠与水反应得到的是Na+而不是Na2+,某学习小组设计了下面两种实验方法加以验证:
第一种:称得一盛水的烧杯总质量为m1 g,称取m g钠投入烧杯中,反应结束后称取烧杯及液体的总质量为m2 g,据此推测产物中钠的化合价为+n价。
第二种:在第一种方法所得溶液中加过量CuSO4溶液,过滤、洗涤、干燥,称量沉淀质量为m2 g,据此推测产物中钠的化合价为+n价。
请列出这两种方法的数学表达式。
参考答案:第一种 m2-m1=(23-n)÷23×m????第二种m2
本题解析:钠与水反应产生OH-,可通过反应后溶液使无色酚酞变红证明,产生的H2可通过收集点燃得到证明。这两种都是定性的方法,即只能证明有无这种物质,而不能说明有多少这种物质。要证明钠反应后产生的是Na+,即一个钠原子只失去一个电子,这就涉及到定量的关系,只有通过定量的实验,严密的推理才能实现。第一种方法中,利用了钠与水反应时液体质量的差量与钠价态的关系,即23g钠与水反应时,若生成+n价钠离子,则液体增重(23-n) g,m g钠使液体增重(23-n)÷23×m g。第二种方法中,利用了钠与水反应产生的OH-去沉淀
本题难度:简单