微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已建立化学平衡的某可逆反应,当改变某反应条件使平衡向正反应方向移动时,下列有关叙述正确的是
A.正反应速率一定增大
B.生成物的质量分数一定增大
C.逆反应速率一定减小
D.至少有一种反应物的转化率增大
参考答案:D
本题解析:平衡向正反应方向移动,只能说明正反应速率大于逆反应速率,而它们的值到底是增大还是减小,不能确定,故排除AC
当通过增大反应物的浓度使平衡正向移动时,生成物的质量分数不一定增大,排除B
答案为D(当反应物只有一种物质时,D项也是错误的)
本题难度:一般
2、填空题 在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ?xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
?xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________
(2)正反应是放热反应,则升高温度,正反应速率???????,逆反应速率???????。(填升高、降低或不变)
(3)B的转化率为_________。
(4)能判断该反应达到平衡状态的依据是________(填字母)
A.混合气体的密度不变
B.容器中的压强不再变化
C.生成D的反应速率是生成B的反应速率的2倍
D.单位时间内生成3molA,同时生成1molB
参考答案:x=1,升高,升高,40%,BC
本题解析:考查可逆反应的有关计算、外界条件对反应速率的影响及平衡状态的判断。
(1)平衡时C的浓度是0.2mol/L,其物质的量是0.2mol/L×2=0.4mol,及C和D的物质的量之比是1︰2,所以x是1.
(2)升高温度正逆反应速率均是增大的,与反应是放热或吸热无关。
(3)根据反应式可知每生成0.2mol的C,就消耗0.2mol的B,所以B的转化率是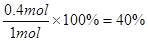 。
。
(4)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时,各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中中,质量和容积都是不变的,所以密度始终是不变的。由于反应前后气体体积是变化的,及压强是变化的,因此当压强不再发生变化时,即达到平衡状态。C中反应速率方向相反,但满足速率之比是相应的化学计量数之比,正确。D中反应速率方向相同,不能说明。答案选BC。
本题难度:一般
3、选择题 在一恒容密闭容器中发生可逆反应:C(s)+H2O(g) CO(g)+H2(g),已达平衡状态,现欲使平衡向正反应方向移动,且v(正)增大,可进行的操作是(??? )
CO(g)+H2(g),已达平衡状态,现欲使平衡向正反应方向移动,且v(正)增大,可进行的操作是(??? )
A.再加入一些C
B.移走一部分CO或H2
C.充入一些水蒸气
D.移走少量H2并充入水蒸气
参考答案:CD
本题解析:本题应从两个方面分析:(1)平衡向正反应方向移动,则v(正)>v(逆);(2)v(正)要增大〔v(正)只与C(反应物)有关〕,其他条件不变时,应增大反应物浓度(但固体反应物浓度恒定)。
据此分析4个选项:A中v(正)不变,且平衡不移动;B中v(正)不变,平衡向正反应方向移动;C中v(正)增大,平衡向正反应方向移动;D中v(正)增大,v(逆)减小,平衡向正反应方向移动。
本题难度:简单
4、选择题 一定条件下,在密闭容器里进行如下可逆反应:

?
S2Cl2(橙黄色液体)+Cl2(气)?????? 2SCl2(鲜红色液体) △H =-61.16 kJ·mol-1下列说法正确的是( )A.单位时间里生成n mol S2Cl2的同时也生成2n mol Cl2
B.达到平衡时,若升高温度,压强不变,反应混合溶液颜色变浅
C.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n mol Cl2
D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
参考答案:B
本题解析:略
本题难度:简单
5、选择题 已知某可逆反应mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是 pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2、P1>P2、m+n>p,⊿H <0;
B.T1>T2、P1<P2、m+n>p,⊿H >0;
C.T1>T2、P1<P2、m+n<p,⊿H >0;
D.T1<T2、P1>P2、m+n<p,⊿H <0;
参考答案:C
本题解析:由图T1P1和T1P2,可知P2>P1;增大压强,B%增大,平衡逆向移动,逆向体积减小,故m+n<P;有T1P2和T2P2,可知T1>T2,温度升高,B%减小,平衡正向移动,正反应吸热,⊿H >0。
本题难度:一般
|