微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现向一密闭容器中充入1 mol N2和 3 mol H2,在一定条件下开始反应。下列有关说法中正确的是( )
A.达到化学平衡时,将生成2 mol NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
参考答案:C
本题解析:
试题分析:该反应是可逆反应,所以不可能生成2mol氨气,A不正确;在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以C正确,D不正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此B不正确,答案选C。
点评:该题是高考中的常见考点,主要是考查学生对可逆反应平衡状态的熟悉了解程度,有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是理解并能熟练记住可逆反应的平衡状态特点,然后灵活运用即可。
本题难度:简单
2、填空题 (10分)向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
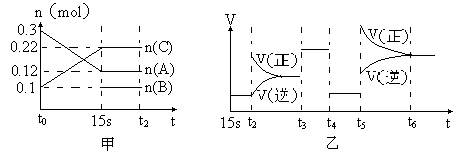
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为?????????????。
(2)乙图中t2时引起平衡移动的条件是?????????????????????,t5时引起平衡移动的条件是?????????????????????。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是?????????。
(4)该反应的化学方程式可以表示为:?????????????????????????????????????????,正反应为???????????(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为?????????????????。
参考答案:(1)?? 0.004????? mol/Ls????(2分
本题解析:略
本题难度:一般
3、计算题 在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数。
参考答案:(1)25%?? 1
(2)1.33mol?? 22.
本题解析:
试题分析:??????? CO(g)?? +?? H2O(g)?? ???CO2(g)?? +?? H2(g)
???CO2(g)?? +?? H2(g)
起始物质的量:?? 1.0mol?????? 1.0mol??????????? 0?????????? 0
转化:???????????x?????????? x??????????????? x?????????? x
平衡物质的量:?? (1-x)mol???? (1-x)mol?????????? x??????????x
依题意可知: x=0.5mol
达到平衡时CO2的物质的量分数为:x/2=0.25=25%
该反应的化学平衡常数: 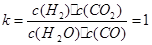
⑵?????????????????????? CO(g)?? +?? H2O(g)?? ???CO2(g)?? +?? H2(g)
???CO2(g)?? +?? H2(g)
平衡时各物质的浓度:??? 0.5mol??????? 0.5mol???????? 0.5mol?????? 0.5mol
通入1.0mol水蒸气:???? 0.5mol??????? 1.5mol???????? 0.5mol?????? 0.5mol
转化:????? y??????????? y????????????? y?????????? y
再次平衡:??(0.5-y)????? (1.5-y)???????? (0.5+y)?????? (0.5+y)
依据平衡常数有:
解之得: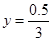
水蒸气的物质的量:n(H2O)=1.5-0.5/3=4/3mol
CO2的物质的量分数: 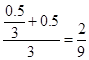
本题难度:一般
4、选择题 在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的??????????????????????????????????
CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的??????????????????????????????????
A.5.75倍
B.11.5倍
C.30.67倍
D.46倍
参考答案:B
本题解析:平衡混合气体与氢气的密度比就等于分子量比。此题的关

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的

为相同条件下H2密度为11.5倍。
本题难度:一般
5、选择题 一定条件下,对于反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零)。达平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )。
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零)。达平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )。
①c1∶c2=1∶3 ②平衡时,Y和Z的生成速率之比2∶3
③X和Y的转化率不相等 ④c1的取值范围为0<c1<0.14 mol·L-1
A.①②
B.③④
C.①④
D.②③
参考答案:D
本题解析:分析浓度变化关系:X(g)+3Y(g)  2Z(g)
2Z(g)
c起始/(mol·L-1)? c1? c2? c3
c平衡/(mol·L-1)? 0.1? 0.3? 0.08
反应的化学方程式中反应物化学计量数之比为1∶3,所以反应中X和Y必然以1∶3消耗,因为达平衡时X和Y浓度之比为1∶3,故c1∶c2=1∶3,①正确;平衡时Y和Z的生成速率之比应该和化学方程式对应化学计量数之比相等,故Y和Z的生成速率之比为3∶2,②错误;由于起始时反应物是按化学方程式化学计量数之比配料,故X和Y转化率相等,③错误;运用极限法,假设Z完全转化为反应物,c1的极限值为0.14 mol·L-1,而题设c1>0,反应又是可逆的,故④也正确。
本题难度:一般