检验制得气体是否为乙烯
参考答案:B
本题解析:
试题分析:A、某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该钾盐可能含CO32-、HCO3-,故A错误;B、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故B正确;C、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故C错误;D、C2H5OH与制得的乙烯都有还原性,通入酸性KMnO4溶液都会褪色,故D错误。
考点:本题考查实验方案的设计与分析。
本题难度:一般
2、选择题 已知氯化银在水中存在沉淀溶解平衡:AgCl Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是(??) Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是(??)
A.100mL蒸馏水中
B.50mL0.1mol?L-1的氯化镁溶液
C.150mL0.1mol?L-1的氯化钠溶液
D.50mL0.1mol?L-1的氯化铝溶液
参考答案:D
本题解析:略
本题难度:一般
3、简答题 (20分)硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
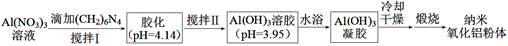
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。

②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化: 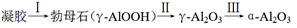 。 。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:
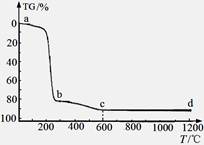
(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
参考答案:(20分)
(1)B(2分)
(2)2Al+6H
本题解析:
试题分析:(1)硝酸铝中氮元素的化合价为+5,处于最高价,所以硝酸铝具有氧化性,在实验室中,硝酸铝必须与可燃物分开存放,故B项正确。
(2)Al作电极电解HNO3溶液制取Al(NO3)3,阳极上Al失电子生成Al3+,阴极上H+得电子生成H2,所以电解反应的离子方程式为:2Al+6H+ 2Al3++3H2↑。 2Al3++3H2↑。
(3)[Al(OH)]2+结合H2O中的羟基可转化为[Al(OH)2]+,所以离子方程式为:[Al(OH)]2++H2O [Al(OH)2]++H+。 [Al(OH)2]++H+。
(4)①根据元素守恒和电荷守恒,可知所缺离子为阳离子且含有N元素,为NH4+,根据观察法可配平该离子方程式。
②溶液中含有Al3+,经搅拌Ⅱ,Al3+的水解程度增大,所以pH下降。
③加入(CH2)6N4后生成NH4+,所以溶液中含有NH4NO3,根据pH=3.95可得c(OH?)=10-14÷10-3.95=10-10.05,则c(Al3+)=Ksp[Al(OH)3]÷c(OH?)3=1.3×10-33÷(10-10.05)3=1.3×10-2.85mol?L?1>1×10-5 mol·L-1,所以溶液还含有Al(NO3)3。
④转化II由γ-AlOOH转化为γ-Al2O3,失重率=18÷120×100%=12%,根据图像可知对应的失重阶段是i;转化III有γ-Al2O3转化为α-Al2O3,根据图像可知对应的失重阶段是iii,开始温度是600℃。
考点:本题考查物质的性质及应用、电解原理、方程式的配平及书写、化学流程及图像的分析。
本题难度:困难
4、选择题 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> Ag2CrO4
B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
参考答案:C
本题解析:碘化银的溶度积常数小于氯化银的,所以碘化银溶液中银离子小于氯化银溶液中银离子浓度。根据溶度积常数的表达式可知,氯化银溶液中银离子浓度= ,铬酸银溶液中银离子浓度= ,铬酸银溶液中银离子浓度= 本题难度:一般 本题难度:一般
5、填空题 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
I、已知H2A在水中存在以下平衡:H2A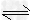 ?H++HA-,HA-? ?H++HA-,HA-?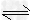 H++A2-。 H++A2-。
⑴NaHA溶液_________?(选填“显酸性”、?“显碱性”、?“显中性”或“无法确定”)。
⑵某温度下,若向0.1?mol/L的NaHA溶液中逐滴滴加0.1?mol/L?KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是__________。
a.c(H+)·c(OH-)=1×10
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)??????????????
d.c(Na+)+c(K+)=0.05?mol/L
⑶已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡: CaA(s)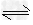 ?Ca2+(aq)+A2-(aq)??△H>0。 ?Ca2+(aq)+A2-(aq)??△H>0。
①温度降低时,Ksp_________??(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)?___________。
II、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3?mol·L-1的Cr2O72-。为使废水能达标排放,作如下处理:
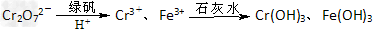
⑷欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入_________?g?FeSO4·7H2O。
⑸若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为___________??。(已知:Ksp[Fe(OH)3]=4.0×10-38???Ksp[Cr(OH)3]=6.0×10-31)
参考答案:⑴无法确定????????????
⑵bc
⑶
本题解析:
本题难度:一般
|