微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
2、选择题 根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:FeS不溶于水,但溶于酸;在除去溶液中的Fe2+时,可采用的方法是( )
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+
完全生成氢氧化物沉淀时,溶液的pH
≥3.7
≥9.6
≥6.4
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
3、选择题 下列说法错误的是 [???? ]
A.铅蓄电池在放电过程中,负极质量最终减小,正极质量最终增加
B.放热反应不一定能自发进行
C.一定条件下,使用催化剂能加快反应速率,但不能提高反应物的平衡转化率
D.温度一定,当溶液中Ag+和Cl-浓渡的乘积等于Ksp时,溶液为AgCl的饱和溶液
4、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s)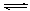 Al(OH)3(aq) Al(OH)3(aq) 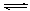 Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
5、填空题 (12分)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O), 为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
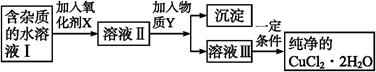
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+
| Fe2+
| Cu2+
| 氢氧化物开始沉淀时的pH
| 1.9
| 7.0
| 4.7
| 氢氧化物完全沉淀时的pH
| 3.2
| 9.0
| 6.7
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 最适合作氧化剂X的是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂X的目的是 。
(3)为了除去Fe3+,需加入物质Y调节溶液的PH值为
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)已知Fe(OH)3的Ksp=1×10-35mol4/L4;若Fe3+沉淀完全时,在溶液中Fe3+的浓度为1×10-5mol/L, 则此时溶液的PH最小为 .
|
|