微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25℃时,AgCl的溶度积K sp =1.8×10 -10,则下列说法正确的是 [???? ]
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10mol2.L-2,在任何含AgCl 固体的溶液中,c(Ag+) =c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2.L-2
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大
参考答案:C
本题解析:
本题难度:一般
2、选择题 根据下图溶解度曲线,在恒定70℃将物质的量浓度相等的硝酸钠溶液和氯化钾溶液等体积混合降温至25℃,首先析出的是

A.氯化钠
B.硝酸钠
C.氯化钾
D.硝酸钾
参考答案:D
本题解析:
正确答案:D
NaNO3与KCl混合后,溶液中的四种离子将重组, NaNO3+KCl=KNO3↓+NaCl,降温至25℃,KNO3溶解度变化最大,饱和从溶液中析出。
本题难度:简单
3、实验题 (12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol·L-1 Na2C2O4溶液(过量)和25mL 6mol·L-1 HNO3溶液,在6070℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol·L-1 KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol·L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]。
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
参考答案:(1)pH≤8.5
(2)溶液变成浅红色,且半分钟内不
本题解析:
试题分析:(1)已知Mn(OH)2的Ksp=2.0×10-13=c(Mn2+)×c(OH-)2,c(OH-)= =
= mol/L, c(H+)=
mol/L, c(H+)= =
= ,pH=8.5,要防止锰离子变成氢氧化锰沉淀,故pH≤8.5;
,pH=8.5,要防止锰离子变成氢氧化锰沉淀,故pH≤8.5;
(2)当溶液变成浅红色,且半分钟内不褪色时,说明到达了滴定终点;
(3)终点读数时俯视刻度时,会导致滴定结果偏大;
(4)样品溶解后,滴定消耗高锰酸钾:
10.00 mL×0.02000 mol·L-1="0.2000" mmol
2Mn2+---------------5C2O42-
0.2000 mmol 0.5000 mmol
样品溶解过程所消耗的C2O42-量:25.00 mL×0.06000 mol·L-1-0.5000 mmol="1.000" mmol
La2Ca2MnOx中Mn的化合价为(2x-10) ,La2Ca2MnOx中锰得电子数与C2O42-失电子数 相等:
 ×(2x-10-2)=2×1.000×10-3 解得:x=7
×(2x-10-2)=2×1.000×10-3 解得:x=7
考点:滴定终点的判断,滴定的相关计算,pH的计算
本题难度:困难
4、选择题 对“ ”的理解正确的是(??? )。
”的理解正确的是(??? )。
A.说明AgCl没有完全电离,AgCl是弱电解质
B.说明溶解的AgCl已完全电离,AgCl是强电解质
C.说明Ag+与Cl-的反应不能完全进行到底
D.说明Ag+与Cl-的反应可以完全进行到底
参考答案:C
本题解析:
试题分析:  ,该方程式表示AgCl的溶解平衡,溶解平衡的含义就是离子结合成沉淀的速率等于沉淀电离成离子的速率,所以说明Ag+与Cl-的反应不能完全进行到底,答案选C。
,该方程式表示AgCl的溶解平衡,溶解平衡的含义就是离子结合成沉淀的速率等于沉淀电离成离子的速率,所以说明Ag+与Cl-的反应不能完全进行到底,答案选C。
本题难度:一般
5、填空题 (12分)水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度。为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟。
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸。
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤。
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置。
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解。
步骤6:滴定:用0.1000 mol·L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL。反应的化学方程式为:2 KMnO4+5 H2C2O4+3H2SO4= K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式: ;
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol·L-1,pH≥ ;
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程)。
参考答案:(1)Al3++3NH3?H2O=Al(OH)3↓+3NH4
本题解析:
试题分析:(1)稀氨水能与Al3+反应生成氢氧化铝沉淀和铵根离子:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)欲使溶液中c(Al3+)≤l.0×l0-6mol?L-1,C(OH-)≥ =
= =l.0×l0-9mol?L-1,
=l.0×l0-9mol?L-1,
c(H+)≥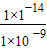 mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
(3)5CaO~ 5CaC2O4 ~ 2KMnO4
5×56g 2mol
m(CaO) 0.1000mol?L-1×0.013L
 解得:m(CaO)=0.182g,氧化钙的质量分数为:
解得:m(CaO)=0.182g,氧化钙的质量分数为: ×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
考点:考查沉淀溶解平衡的计算,利用化学方程式的计算等知识。
本题难度:困难