微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 含MgCl2、FeCl3、Al2(SO4)3三种溶质的混合溶液中,已知Cl-为1.5mol,Al3+和Fe3+共0.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.1mol
B.0.5mol
C.0.25mol
D.0.15mol
参考答案:B
本题解析:分析:令硫酸根的物质的量为n,根据溶液中阴阳离子所带的正负电荷总数相等,列式计算n值.据此判断.
解答:令硫酸根的物质的量为n,根据溶液中阴阳离子所带的正负电荷总数相等,则:
0.5mol×3+0.5mol×2=1.5mol×1+2n
解得:n=0.5mol.
故选:B.
点评:考查溶液物质的量浓度的计算,浓度不大,利用常规解法,比较麻烦,本题根据溶液不显电性阳离子与阴离子所带电荷总数相等,即电荷守恒原则解答,注意电荷守恒原则在混合溶液有关离子浓度计算经常运用.
本题难度:困难
2、选择题 下列气体中所含分子数目最多的是
A.1gH2
B.10gO2
C.30gCl2
D.17gNH3
参考答案:D
本题解析:分析:根据n= 计算各物质的物质的量,根据N=nNA可知,物质的量越大,所含的分子数越多,据此判断.
计算各物质的物质的量,根据N=nNA可知,物质的量越大,所含的分子数越多,据此判断.
解答:A、1gH2的物质的量为 =0.5mol,
=0.5mol,
B、10gO2的物质的量为 =
= mol,
mol,
C、30gCl2的物质的量为 =
= mol,
mol,
D、17gNH3的物质的量为 =1mol,
=1mol,
所以物质的量由大到小的顺序为D>A>C>B.
故选D.
点评:本题考查常用化学计量数的有关计算,难度较小,关键在于清楚物质的量越大,所含的分子数越多,注意公式运用.
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是
A.64g SO2含有硫原子数为1NA
B.常温常压下,2mol H2的体积是44.8L
C.标准状况下,22.4L H2O的分子数为1NA
D.14g N2含有分子数为0.5NA
参考答案:AD
本题解析:分析:A、根据n= 计算二氧化硫的物质的量,再根据N=nNA计算硫原子数目;
计算二氧化硫的物质的量,再根据N=nNA计算硫原子数目;
B、气体摩尔体积22.4L/mol的使用条件为标准状况;
C、气体摩尔体积的使用范围是气体;
D、根据n= 计算氮气分子的物质的量,再根据N=nNA计算氮气分子数目.
计算氮气分子的物质的量,再根据N=nNA计算氮气分子数目.
解答:A、每个二氧化硫分子含有1个硫原子,使用64g SO2含有硫原子数为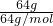 ×1×NAmol-1=NA,故A正确;
×1×NAmol-1=NA,故A正确;
B、不是标准状况,不能使用气体摩尔体积22.4L/mol,故B错误;
C、标准状况下,H2O是液体,不能使用气体摩尔体积22.4L/mol,故C错误;
D、14g N2含有氮气分子数为 ×NAmol-1=0.5NA,故D正确.
×NAmol-1=0.5NA,故D正确.
故选:AD.
点评:考查常用化学计量数的有关计算,难度较小,注意气体摩尔体积的使用条件与范围.
本题难度:困难
4、选择题 对于下列化学事实的表述中,有错误的是
A.浓硝酸需要在棕色瓶中保存,以防止硝酸见光分解
B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,能发生“先沉淀后溶解”的现象
C.向石蕊试液中滴加氯水溶液先变红后褪色
D.向无色溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,证明溶液一定含CO32-
参考答案:D
本题解析:分析:A.浓硝酸不稳定,见光分解;
B.根据胶体的性质,加入稀硫酸产生聚沉现象,随后H2SO4与Fe(OH)3反应;
C.Cl2通入溶液生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性;
D.能使澄清石灰水变浑浊的无色气体有CO2、SO2等;
解答:A.浓硝酸不稳定,见光分解,需要在棕色瓶中保存,故A正确;
B.根据胶体的性质,加入稀硫酸产生聚沉现象,随后H2SO4与Fe(OH)3反应,所以发生“先沉淀后溶解”的现象,故B正确;
C.Cl2通入溶液生成盐酸和次氯酸,盐酸具有酸性,石蕊试液变红,次氯酸具有漂白性,溶液红色褪去,故C正确;
D.向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,气体可能为二氧化硫或二氧化碳,则溶液中可能存在HCO3-、SO32-、HSO3-、CO32-,故D错误;
故选:D;
点评:本题主要考查的是物质的性质,物质的性质决定了用途和保存方法,需要注意的是胶体的性质,如聚沉.
本题难度:困难
5、选择题 下列关于氧化物的叙述中,正确的是
A.酸性氧化物都能与水化合生成酸
B.碱性氧化物都能与水化合生成碱
C.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
D.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
参考答案:C
本题解析:分析:A、酸性氧化物不一定都与水反应生成相应的酸.
B、碱性氧化物不一定都和水反应生成碱;
C、碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物;
D、金属氧化物可以是酸性氧化物或两性氧化物,非金属氧化物可以是不成盐氧化物.
解答:A、酸性氧化物不一定都与水反应生成相应的酸,如SiO2不溶于水,但二氧化硅是酸性氧化物,故A错误;
B、碱性氧化物不一定都和水反应生成碱,如Fe2O3是碱性氧化物但不与水反应,故B错误;
C、碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物,如:Mn2O7是酸性氧化物,故C正确;
D、金属氧化物可以是酸性氧化物或两性氧化物,如:Mn2O7是酸性氧化物,Al2O3是两性氧化物;非金属氧化物可以是不成盐氧化物;如CO属于非金属氧化物但不属于酸性氧化物,故D错误;
故选C.
点评:本题考查了酸碱盐、氧化物的概念及其联系,难度不大,但概念间的联系是学习的难点,属于易错题.
本题难度:简单