微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)①写出NaHSO4在水溶液中的电离方程式______.
②CO2通入足量氢氧化钠溶液反应的离子反应方程式______.
③OH-+H+=H2O改写为化学方程式______.
Cu2++Fe=Fe2++Cu改写为化学方程式______.
(2)①同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为______.
②现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol.若阿伏加德罗常数用NA表示,则该气体所含原子总数为______个.
(3)下列实验操作中不正确的是______(多选).
A.用分液的方法分离水和汽油的混合物B.用过滤的方法分离饱和食盐水与沙子的混合物
C.蒸馏时,应使温度计水银球插入液面以下D.蒸发结晶时应将溶液蒸干后再停止加热
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出.
参考答案:(1)NaHSO4在水溶液中完全电离出三种离子,即NaHSO
本题解析:
本题难度:一般
2、选择题 常温下,下列盐溶于水时,能使水的电离程度增大且c(H+)也增大的是( )
A.NaHSO4
B.KAl(SO4)2
C.NaHCO3
D.CH3COONa
参考答案:B
本题解析:
本题难度:简单
3、填空题 (15分)信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
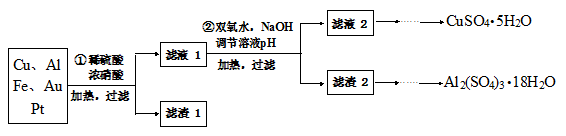
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定(原理为:I2+2S2O32-===2I-+S4O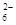 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用 作指示剂,滴定终点的现象是 。
②CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如:Cu2++H2Y2-=CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式ω= 。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。(填序号)
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
参考答案:(15分)
(1)Cu+4H++2NO3-=Cu2++
本题解析:
试题分析:(1)Cu与稀硫酸、浓硝酸的混合液反应,生成铜离子、二氧化氮(或NO)、水,离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)从流程图可知,制备硫酸铝和硫酸铜晶体,需除去铁元素,所以加入过氧化氢的目的是将Fe2+氧化成Fe3+,便于除去;
(3)①Na2S2O3标准溶液滴定溶液中的碘单质,所以选择淀粉作指示剂;碘遇淀粉变蓝色,则滴定终点时,溶液由蓝色变为无色,且半分钟内不恢复;
②根据题意可知硫酸铜与KI溶液发生反应,生成白色沉淀,则该白色沉淀是CuI沉淀,根据氧化还原反应规律,则产物中I元素的化合价升高到0价,有碘单质生成碘,离子方程式为2Cu2++4I-=2CuI↓+I2;
③根据所给数据,EDTA~Cu2+,则溶液中Cu2+的物质的量是6×10-3L×cmol/L×100/20=0.03cmol,则CuSO4·5H2O质量分数为0.03cmol×250g/mol/ag×100%=7.5c/a×100%;
④a.未干燥锥形瓶,对实验结果无影响,错误;b.滴定终点时滴定管尖嘴中产生气泡 ,会导致末读数的数值偏小,测定结果偏低,错误; c.未除净可与EDTA反应的干扰离子,导致消耗EDTA偏多,测定结果偏高,正确,答案选c。
考点:考查物质制备流程图的分析,离子方程式的书写,化学反应的判断,实验结果的计算与误差分析
本题难度:困难
4、实验题 (10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
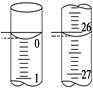
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数
| 待测NaOH溶液的体积/mL
| 0.100 0 mol·L-1盐酸的体积/mL
|
滴定前刻度
| 滴定后刻度
| 溶液体积/mL
|
第一次
| 25.00
| 0.00
| 26.11
| 26.11
|
第二次
| 25.00
| 1.56
| 30.30
| 28.74
|
第三次
| 25.00
| 0.22
| 26.31
| 26.09
依据上表数据列式计算该NaOH溶液的物质的量浓度。(保留4位有效数字)
参考答案:22 (1)锥形瓶中溶液颜色变化 在半分钟内不变色 (2)D
本题解析:
试题分析:(1)眼睛观察的是锥形瓶内指示剂颜色的变化,而不是滴定管中液体的体积变化;判断滴定终点时,注意在指示剂颜色发生变化后,半分钟内不再复原,停止滴定,答案为锥形瓶中溶液颜色变化 在半分钟内不变色;
(2)A.由于未用标准液润洗,导致消耗盐酸的体积比实际上要大,测定的氢氧化钠溶液的浓度偏高。B.无影响;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,直接导致读数比实际值偏大,使测定的氢氧化钠溶液的浓度偏高;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,导致读数比实际上偏小,使测定的氢氧化钠溶液的浓度偏低;选D。
(3)由图可知:滴定前刻度0.00,滴定后刻度26.10,溶液体积26.10;
(4)第二组数据,误差太大,舍去,取第一次和第二次盐酸体积的平均值:V="(26.11+26.09)/2=" 26.10(mL),其浓度为0.100 0 mol/L,待测氢氧化钠溶液的体积为25.00 mL,则该氢氧化钠溶液的物质的量浓度c(NaOH)=c(盐酸)×V(盐酸) /V(NaOH)="0.104" 4 mol/L。
考点:考查酸碱中和滴定。
本题难度:一般
5、选择题 ①pH=0的盐酸②0.5mol·L-1盐酸③0.1mol·L-1的NH4Cl溶液④0.1mol·L-1的NaOH溶液⑤0.5mol·L-1的NH4Cl溶液,以上溶液中水电离的c(H+)由大到小的顺序是( )
A.⑤③④②①
B.①②③⑤④
C.①②③④⑤
D.⑤③④①②
参考答案:A
本题解析:pH=0的盐酸中 ,0.5mol·L-1盐酸中 ,0.5mol·L-1盐酸中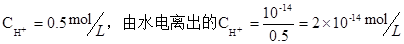 ,0.1mol·L-1的氢氧化钠溶液中 ,0.1mol·L-1的氢氧化钠溶液中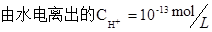 ,NH4Cl溶液中由于铵根离子的水解促进水的电离,,铵根离子的浓度越大促进的能力越强, 所以水电离的c(H+)大小关系为⑤大于③,综上溶液中水电离的c(H+)由大到小的顺序为⑤③④②①,答案选A。 ,NH4Cl溶液中由于铵根离子的水解促进水的电离,,铵根离子的浓度越大促进的能力越强, 所以水电离的c(H+)大小关系为⑤大于③,综上溶液中水电离的c(H+)由大到小的顺序为⑤③④②①,答案选A。
本题难度:一般
|