微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)回答下列问题:
(1) 常温下,pH=5的盐酸和pH=9的氢氧化钠溶液按体积比9∶11混合,混合后溶液的pH为
(2)NH4Cl溶液显酸性,试用离子方程式 表示这一反应_____________________。
表示这一反应_____________________。
(3)已知水的电离方程式可写为2H2O 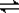
参考答案:
本题解析:
本题难度:一般
2、填空题 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液稀释.后向溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的如下图所示:
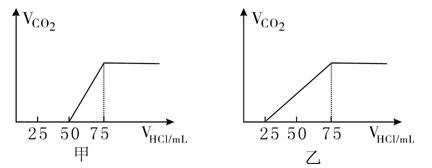
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 ,其物质的量之比是 , 产生的CO2气体体积(标况)是 . 在乙所得溶液中存在的溶质是 ,其物质的量之比是 , 产生的CO2气体体积(标况)是 。
参考答案:甲:NaOH和Na2CO3、1:1、0.056 L;乙:Na
本题解析:NaOH溶液中通入一定量的CO2,有几种情况:一种情况是CO2不足,反应后的混合物为NaOH,Na2CO3;另一种情况是二者恰好完全反应生成Na2CO3;第三种情况是CO2过量,全部NaOH转化为NaHCO3;第四种情况是CO2过量,反应后的混合物为NaHCO3和Na2CO3。
分析甲图像:加入盐酸50mL时开始产生CO2气体,至反应完毕消耗25mL盐酸,根据反应:
Na2CO3+HCl=NaHCO3+NaCl ① NaHCO3+HCl=NaCl+H2O+CO2↑②
可知滴加到50 mL时开始反应②,根据耗酸量可知NaHCO3的物质的量。分析图象加入50mL以前,无气体放出,与盐酸反应转化为NaHCO3应消耗25 mL盐酸,则与NaOH反应的盐酸也应是25 mL。由此得也甲成分只能为NaOH和Na2CO3,且物质的量之比为1:1,产生CO2的体积为0. 056L.

本题难度:一般
3、简答题 25℃时,1L0.01mol/LHCl溶液,水的离子积常数Kw为______,溶液中H+的物质的量浓度为______,水电离出的H+的物质的量浓度为______,向上述溶液中加入1L0.008mol/L的NaOH溶液,反应后溶液的pH为______.
参考答案:温度不变,溶液中水的离子积不变,与溶液的酸碱性无关,常温下,
本题解析:
本题难度:一般
4、选择题 100℃时关于纯水的叙述正确的是
A.pH=6,呈弱酸性
B.c(H+)=10-6 mol/L,溶液为中性
C.Kw值是常温时的10-2倍
D.pH=7,溶液为中性
参考答案:B
本题解析:100℃时的纯水c(H+)=10-6 mol/L,pH=6,呈中性;Kw值是常温时的102倍.
本题难度:困难
5、选择题 下列溶液一定显酸性的是( )
A.溶液中c(OH-)>c(H+)
B.滴加紫色石蕊试液后变红色的溶液
C.溶液中c(H+)=10-6?mol/L
D.pH<7的溶液
参考答案:B
本题解析:
本题难度:一般