微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应2SO2+O2 2SO3下列判断正确的是
2SO3下列判断正确的是
A.2 mol SO2和足量的O2反应,必生成2 mol SO3
B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2
C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍
D.平衡时SO2的浓度必为O2浓度的2倍
参考答案:C
本题解析:
试题分析:A.由于该反应是可逆反应,反应不可能完全进行,所以2 mol SO2和足量的O2反应,产生的SO3的物质的量必然小于2 mol。错误。B.物质在反应变化时这几种物质的SO2、O2、SO3的分子数之比为2∶1∶2,但是平衡时不一定是这种关系。错误。C.因为在平衡时任何物质的消耗速率与产生速率相同。在任何时刻SO2的消耗速率必定等于O2的消耗速率的2倍。SO2的消耗速率等于O2生成速率的2倍,则说明O2的消耗速率等于O2生成速率,因此反应达到平衡状态。正确。D.如果起始加入的SO2、O2的物质的量的比为2:1,因为在反应过程中二者的消耗的比为2:1,所以平衡时SO2的浓度为O2浓度的2倍。若加入的比例不是2:1,则达到平衡时SO2的浓度就不是O2浓度的2倍。错误。
本题难度:一般
2、填空题 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g) Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
②Ni(CO)4(g)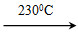 Ni(s)+4CO(g)
Ni(s)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____________、____________ 。
(2)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________?。
a.平衡常数K增大 ???? b.CO的浓度减小
c.Ni的质量减小????? d.v逆[Ni(CO)4]增大
(3)简述羰基法提纯粗镍的操作过程____________________________________________。
参考答案:(1)增大CO浓度 加压 (2)bc
(3)把粗镍和C
本题解析:(1)反应①是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温度不变的情况下可采取增大CO浓度,加压的方法提高产率;
(2)反应(2)是正向气体体积增大的吸热反应,则降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆[Ni(CO)4]减小;(3)根据反应①②的特点可提纯粗镍。
本题难度:一般
3、选择题 一定条件下将2 mol SO2和2 mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量大于n mol的是(???)
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量大于n mol的是(???)
A.2 mol SO2+1 mol O2
B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+ 2 mol SO3
D.3 mol SO2+1 mol O2+1 mol SO3
参考答案:CD
本题解析:因为加入2 mol SO2、2 mol SO3和以下两种加入物质的情况是完全等同的:①4 mol SO2、1 mol O2;②3 mol SO2、0.5mol O2、1 mol SO3。所以按A加入物质达到平衡状态时SO3会小于n mol;按B加入物质达到平衡状态时SO3恰好为n mol;C可以看成是先加入2 mol SO2、2 mol SO3,待反应达到平衡状态后再加入1 mol O2,达到新平衡状态时SO3的物质的量大于n mol;D可以看成是先加入3 mol SO2、0.5 mol O2、1 mol SO3,反应达到平衡状态后再加入0.5 mol O2,达到新平衡状态时SO3的物质的量大于n mol。所以选C、D。
本题难度:简单
4、填空题 (本题共8分)某研究小组向2 L密闭容器中加入过量的活性炭和0.2 mol NO,恒温(T1℃)下发生反应:C(s)+2NO(g) ?N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
?N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
1.该反应的平衡常数表达式K=______;T1℃达到平衡时,N2的平均反应速率=_______。
2.30 min后,若改变某一条件提高NO的转化率,则可以改变的条件是______________。
3.30 min后,升高温度至T2℃,达到平衡后,容器内NO、N2、CO2的关系不可能是____。
a.5:3:3???????? b.1:1:1??????????????? c.4:3:3???????? d.2:1:1
4.若开始时密闭容器的体积为1 L,其它条件不变,达到平衡后,与原平衡相比,下列说法正确的是_________。
a.NO的转化率不变????????????????????????????????????? b.N2的浓度是原来的2倍
c.反应放出的热量为0.1Q???????????????????????????? d.达到平衡的时间是原来的一半
参考答案:(本题共8分,每小题2分)
1.K=
本题解析:1、C(s)+2NO(g) ?N2(g)?+??? CO2(g)
?N2(g)?+??? CO2(g)
初始:???????????0.2mol?????????0?????????????0
△n??????????????0.12mol?????? 0.06mol????? 0.06mol
30 min:????????????0.08mol?????? 0.06mol?????? 0.06mol
3、30 min平衡时三气体的物质的量比为:4:3:3;升温则平衡左移,NO增多,而另外二者减少
4、若开始时密闭容器的体积为1 L,可理解为加压,平衡不移动,但各气体的浓度等倍数增加。
本题难度:一般
5、选择题 往一真空密闭容器中通入一定量的气体A,在一定温度下,发生如下反应:
2A(g)?B(g)+xC(g)反应达平衡时,测得容器内压强增大了p%,若此时A的转化率为a%,下列关系正确的是
①若x=1,则p>a??②若x=2,则p<a??③若x=3,则p=a??④若x=4,则p≥a( )
A.②③
B.①④
C.②③④
D.②④
参考答案:设开始时加入气体A的物质的量为1 mol,则由题意得?
本题解析:
本题难度:简单