409
???下列说法正确的是:
A.反应I2(aq)+I-(aq) 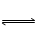 ??I3-(aq)的△H>0 ??I3-(aq)的△H>0
B. 其他条件不变,加入KI固体平衡向正反应方向移动,所以溶液中c(I-)减小
C. 其他条件不变,升高温度,溶液中c(I3-)减小
D.25℃时,向溶液中加入少量KI固体,平衡正向移动,平衡常数K会大于680
参考答案:C
本题解析:随着温度的升高,平衡常数逐渐减小,说明平衡向逆反应方向移动,所以反应是放热反应。增大c(I-),平衡向正反应方向移动,根据勒夏特列原理可知,再次平衡时c(I-)仍比原平衡大。升高温度,平衡向逆反应方向移动,溶液中c(I3-)减小。平衡常数只与温度有关,与平衡移动方向无关。答案是C。
本题难度:一般
3、填空题 下列可以证明H2(g)+I2(g) 2HI(g)已达平衡状态的是 。? 2HI(g)已达平衡状态的是 。?
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2)
④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
参考答案:②⑥
本题解析:该反应是一个反应前后气体物质的量保持不变的反应,因此压强、平均相对分子质量不变不能作为平衡判据。
本题难度:一般
4、选择题 在一个固定体积的密闭容器中,放入3L X(气)和2L Y(气),在一定条件下发生下列反应 4 X (g) + 3 Y(g) 2 Q(g) + n R(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小33.3%,则该反应方程式的n值是(? ) 2 Q(g) + n R(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小33.3%,则该反应方程式的n值是(? )
A? 6???????? B? 5???????? C? 4??????? D? 3
参考答案:A
本题解析:达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,所以4+3<2+n,解得n>5,所以选项A正确,答案选A。
本题难度:一般
5、选择题 已知某可逆反应mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是 pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2、P1>P2、m+n>p,⊿H <0;
B.T1>T2、P1<P2、m+n>p,⊿H >0;
C.T1>T2、P1<P2、m+n<p,⊿H >0;
D.T1<T2、P1>P2、m+n<p,⊿H <0;
参考答案:C
本题解析:由图T1P1和T1P2,可知P2>P1;增大压强,B%增大,平衡逆向移动,逆向体积减小,故m+n<P;有T1P2和T2P2,可知T1>T2,温度升高,B%减小,平衡正向移动,正反应吸热,⊿H >0。
本题难度:一般
|