微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:????????????????????????????。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:??????????????????????????。
(3)在T1℃时,将5 mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①求该反应的平衡常数K=????????(数字代入式子即可),上述平衡体系中O2的体积分数为__________。
②用O2表示从0~5 min内该反应的平均速率υ(O2)=????????。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有????????。
A.压强???????????B.密度??????????C.反应速率??????????D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小?? B.都引起a增大?? C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
参考答案:(14分,每空2分) (1) N4(g)=2N2(g);△H
本题解析:
试题分析:(1)化学反应的焓变等于反应物键能和与生成物键能和之差。?H=6mol×167kJ·mol–1–2mol×942 kJ·mol–1=–882kJ·mol–1(1molN4中有6molN—N键),故热化学方程式为:N4(g)=2N2(g);△H=-882 kJ· mol–1。
(2)氨气燃料电池的总反应为:4NH3 + 3O2 = 2N2 + 6H2O(其产物与燃料反应产物相同),则负极反应:4NH3 - 12e– + 12OH– = 2N2 + 12H2O 正极反应:3O2 + 1
本题难度:困难
2、选择题 关于由锌片、铜片和稀硫酸组成的原电池的说法中,正确的是
A.锌片质量逐渐减少,铜片上有气泡产生
B.电流方向是由锌片流向铜片
C.锌片作正极,发生还原反应
D.电解质溶液的pH保持不变
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极放电。所以选项A正确。
本题难度:一般
3、选择题 上海自主研发了一种氢燃料汽车。它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是(??? )。
A.正极反应:O2 + 2H2O + 4e- ="==" 4OH-
B.当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件)
C.发生氧化反应的是负极
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
参考答案:B
本题解析:
试题分析:A、氢氧燃料电池的正极是氧气发生还原反应,此电池的电解质是氢氧化钾,所以O2 + 2H2O + 4e- ="==" 4OH-,正确;B、正极消耗氧气,负极消耗氢气,错误; C、氢氧燃料电池发生氧化反应的是负极,正确;D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池,正确,答案选B。
本题难度:一般
4、选择题 将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯的溶液中H+浓度均减小
D.乙装置中化学能转化为电能
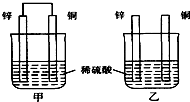
参考答案:A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜
本题解析:
本题难度:一般
5、选择题 下列叙述中,可以说明金属甲的活泼性比金属乙的活泼性强的是(??)
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是负极
参考答案:CD
本题解析:本题考查金属活动顺序和原电池的概念。金属活动性与其在氧化还原反应中失去电子的个数无关。形成原电池时,较活泼的金属为负极。与盐酸反应与否,可判断金属活动性。较活泼的金属原子失去电子形成的离子的氧化性较弱,如钠原子较铝原子活泼,而钠离子比铝离子氧化性弱,所以应选C、D。
本题难度:一般