微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,向一定浓度的醋酸溶液中逐滴加入氢氧化钠溶液直至过量,在此操作过程中,有关溶液中离子浓度变化的大小关系不正确的是??????????????????????????????????????????????????????????????(???)
A.当pH=7时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
B.当pH>7时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.当恰好完全中和时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.反应全程都有关系:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
参考答案:B
本题解析:略
本题难度:一般
2、选择题 常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH > 7,且c(OH-) > c(Na+) >c(H+) >c(CH3COO-)
B.pH > 7,且c(Na+) + c(H+) = c(OH-) + c(CH3COO-)
C.pH < 7,且c(CH3COO-) >c(H+) > c(Na+) > c(OH-)
D.pH = 7,且c(CH3COO-) = c(Na+) > c(H+) = c(OH-)
参考答案:A
本题解析:
正确答案:A
A、违背电荷守恒规律;B、电荷守恒; C、正确;D、由电荷守恒c(Na+) + c(H+) = c(OH-) + c(CH3COO-),可知,中性时,c(CH3COO-) = c(Na+) > c(H+) = c(OH-)
本题难度:一般
3、填空题 (10分)请仔细观察两种电池的构造示意图,完成下列问题:

锌锰电池的构造??????碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
物质
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
| Mn(OH)2
|
开始沉淀pH
| 2.7
| 7.6
| 5.7
| 8.3
|
完全沉淀pH
| 3.7
| 9.6
| 8.0
| 8.8
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。
参考答案:(1)Zn+2OH--2e-====Zn(OH)2???
本题解析:
试题分析:(1)总反应减去正极反应就得负极反应:Zn+2OH--2e-====Zn(OH)2。
(2)从锌锰电池和碱性锌锰电池的结构图可以看出碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大.
(3)①锌锰电池放点后得到MnOOH和Zn(OH)2,因此在废旧电池拆出的锰粉中除了有MnO2、Zn(OH)2外还有MnOOH。
②根据金属离子开始沉淀和完全沉淀的pH,可以看出在pH=8.0时,Zn(OH)2和Fe(OH)3沉淀完全。
本题难度:一般
4、选择题 若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
A.c(Na+)= c(Ac—)+c(HAc)
B.c(Na+)+c(OH—)= c(Ac— )+c(H+)
C.c(Na+)>c(OH—) > c(Ac—) > c(H+)
D.c(Na+)> c(Ac—)> c(H+)> c(OH—)
参考答案:A
本题解析:
试题分析:0.1mol·L-1 NaAc溶液中存在着Na+、Ac-、HAc、H+、OH-。其溶液中的三个守恒式为:①物料守恒:c(Na+)=c(Ac—)+c(HAc)=0.1mol·L-1 ;②电荷守恒:c(Na+)+c(H+)= c(Ac— )+c(OH—);③质子守恒:c(OH—)=c(H+)+c(HAc);由于离子的水解,故溶液中各离子的浓度大小关系为:c(Na+)> c(Ac—)> c(OH—)> c(H+)。综上,答案选A。
点评:解答此题的关键在于熟练掌握电解质
本题难度:一般
5、选择题 在略显碱性的Na2HPO4溶液中存在着如下电离平衡:
  H++ H++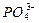 ,欲使溶液中c( ,欲使溶液中c( )、c(H+)、c( )、c(H+)、c(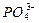 )都减小,可以采取的方法是() )都减小,可以采取的方法是()
A.加NaOH
B.加盐酸
C.加石灰水
D.加水
参考答案:C
本题解析:加盐酸使溶液中c(H+)增大,平衡左移,c( )增大,加入NaOH会中和H+,使平衡右移,使c( )增大,加入NaOH会中和H+,使平衡右移,使c(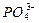 )增大,但加入Ca( )增大,但加入Ca(
本题难度:简单
|