微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是
A.BaCl2、H2SO4、MgCl2
B.CaCl2、HNO3、BaCl2
C.CaCl2、HNO3、NaCl
D.BaCl2、HCl、Na2SO4
参考答案:D
本题解析:
试题分析:碳酸钠溶液与甲反应生成白色沉淀,则甲是氯化钡或氯化钙,白色沉淀是碳酸钡或碳酸钙沉淀。白色沉淀能和过量的乙反应生成气体,因此乙应该是酸。所得溶液中继续加入丙又产生白色沉淀,所以丙应该是硫酸,产生的白色沉淀是硫酸钡,则甲是氯化钡,因此正确的答案选D。
本题难度:一般
2、选择题 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量的关系如图所示则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
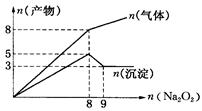
A.2 mol、3 mol、8 mol
B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、4 mol
参考答案:C
本题解析:
试题分析:2Na2O2 + 2H2O =" 4NaOH" + O2↑?分析图中拐点可以得出,当Na2O2的量为8mol时产生4mol氧气,Al3+、Mg2+、NH4+反应完全,到9mol时,氢氧化铝溶解完全,故有
n(Al3+)=n(Al(OH)3)=2mol
n(NH4+)=n(NH3)=8-4=4mol
n(Mg2+)=n(Mg(OH)2)=3mol
本题难度:一般
3、填空题 (9分)若检验某溶液中是否存在下列离子:SO32-、SO42-、CO32-、S2-、Cl-、Br-、I-,根据下列事实分别做出适当结论:
(1)若溶液呈强酸性,不能大量存在的离子是 。
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是 。
(3)加入氯水后溶液仍为无色透明,不存在的离子是 。
参考答案:(1)SO32—、CO32-、S2-??(2)SO42-??
本题解析:考查离子的共存、检验
(1)强酸性溶液中,弱酸根离子不可能大量存在:SO32—、CO32-、S2-
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,说明原溶液中无SO42-
(3)由于可发生反应Cl2+S2-=S↓+2Cl-?? Cl2+2Br-=Br2+2Cl-?? Cl2+2I-=I2+2Cl-,产物硫为浑浊、溴水、碘水均有颜色,故原溶液中不可能存在S2-、Br-、I-(注:氯水本身为淡黄绿色)
本题难度:简单
4、选择题 下列物质中属于电解质的是
A.硫酸铜
B.氮气
C.酒精
D.蔗糖
参考答案:A
本题解析:试题分析:硫酸铜在水溶液里能电离出自由移动的离子,属于电解质;氮气是单质,既不是电解质也不是非电解质;蔗糖在水溶液里或熔融状态下都不导电,属于非电解质。酒精在水溶液里或熔融状态下都不导电是非电解质。
考点:电解质、非电解质。
本题难度:简单
5、填空题 (10分)现有A、B、C、D、E、F六种物质,已知它们的阳离子有:H+、K+、NH4+、Ca2+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、NO3-、CO32-、SO42-。将上述六来源:91考试网 91eXAm.org种物质溶于水均配成0.1mol/L溶液,进行如下实验。
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C。
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失。
③向F中加入A有无色气体生成。
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体。
(1)根据以上信息,填写下列溶液中溶质的化学式 C ________????? E ________??
(2)书写D与过量的E反应的离子方程式。
(3)书写实验④中反应的离子方程式。
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为____________。
参考答案:(1)? C: NH4NO3? (2分)?? E: Ba(O
本题解析:(1)有色气体应该是氯气,所以应该是ClO-氧化Cl-生成氯气。又因为仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C,所以A是氯化氢。由于铝离子的水解程度大于NH4+的水解程度,因此D中含有Al3+,C中含有NH4+。向F中加入A有无色气体生成,所以F是碳酸钾。D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,这说明沉淀应该是氢氧化铝和硫酸钡,则E是氢氧化钡,D是硫酸铝。所以B是次氯酸钙,C是硝酸铵。
(2)D与过量的E反应的离子方程式2Al3+ + 3SO42- +8O
本题难度:一般