本题解析:
试题分析:(1)根据流程图可知,硫酸铵与MgO加热产生的气体可与硫酸反应有生成硫酸铵,所以该气体为氨气,所以MgO与铵根离子水解生成的氢离子反应,促进铵根离子的水解,家入围生成氨气,则硫酸铵与MgO在加热条件下反应生成氨气和镁离子、水,离子方程式是2NH4+MgO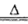 Mg2++2NH3↑+H2O;
Mg2++2NH3↑+H2O;
(2)得到的溶液为硫酸镁溶液,因为镁离子水解,生成氢氧化镁和硫酸,所以调节溶液的pHpH=6.0~6.5的目的是抑制Mg2+水解,以便得到较纯的产品;
(3)虽然镁离子水解生成氢氧化镁和硫酸,但硫酸是高沸点酸,不易挥发,则水解不会进行彻底,所以加热硫酸镁晶体能得到无水MgSO4固体;
(4)从溶液中得到晶体的操作为蒸发浓缩、冷却结晶,过滤,所以步骤⑤的操作为蒸发浓缩、冷却结晶;
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,同时有二氧化碳生成,化学方程式是MgCO3+H2O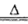 Mg(OH)2+CO2↑;
Mg(OH)2+CO2↑;
(6)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,设氢氧化镁的饱和溶液中氢氧根离子的浓度为x,则5.6×10-12=0.5x×x2,x近似为10-4mol/L,氢氧化镁的饱和溶液的pH近似等于10,所以25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色;
(7)根据实验一可知该碱式碳酸盐3.01g充分灼烧至恒重,生成水和二氧化碳的总质量是1.30g,根据实验二可知,生成的二氧化碳的物质的量是0.112L/22.4L/mol=0.005mol,其质量是0.005mol×44g/mol=0.22g,则水的质量是1.30g-0.22g=1.08g,则水的物质的量是1.08g/18g/mol=0.06mol;根据实验三可知,生成的氢氧化镁的质量是1.74g/mol,则3.01g固体中MgO的物质的量是1.74g/58g/mol=0.03mol,所以氧化铝的质量是(3.01-1.30-0.03mol×40g/mol)g=0.51g,所以Al2O3的物质的量是0.51g/102g/mol=0.005mol,则该药品中Al2O3:MgO:H2O:CO2=0.005:0.03:0.06:0.005=1:6:12:1,所以该药品的化学式是Al2Mg6(OH)16CO3·4H2O。
考点:考查对流程图的分析,基本操作的判断,物质化学式的计算
本题难度:困难
2、选择题 常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L
参考答案:C
本题解析:试题分析:等体积混合后,溶液的溶质应该为NaY,浓度应该为0.15mol/L,但是最后溶液显碱性,说明发生了水解。A选项错误,由pH值计算得到氢离子的浓度为1×10-9 mol/L,则氢氧根离子的浓度应该为1×10-5 mol/L。B选项由于NaY发生水解,则c(Y-)<c(Na+),错误。C选项正确,此等式为质子守恒。D选项最后溶液体积为原来的两倍,钠离子的浓度应该是原来的一半,则为0.15mol/L。
考点:盐类的水解
点评:本题涉及到了一个难点知识盐类的水解,学生在做题时经常会遇到的问题有离子浓度大小的判断,盐类水解中的三个守恒关系的判定,这些需要学生多加练习,熟能生巧。
本题难度:一般
3、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
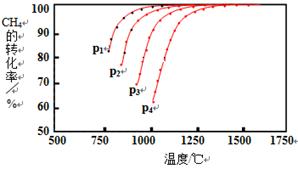
则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
参考答案:Ⅰ.p4>p3>p2>p1;吸热,1024mol2·L-2;
本题解析:
试题分析:I.由图可知,温度降低,转化率下降,则可知该反应为吸热反应,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1;
2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1;
CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
始 5mol 5mol 0 0
转 4mol 4mol 8mol 8mol
平 1mol 1mol 8mol 8mol
平衡浓度:0.5mol/L 0.5mol/L 4mol/L 4mol/L
所以:K= =1024mol2/L2
=1024mol2/L2
II.(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3
那么△H3=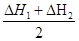 =-867kJ/mol
=-867kJ/mol
因△H3=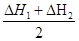 ,那么K3=
,那么K3=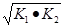
(2)向20mL0.1mol·L-1NaOH溶液通入SO2,由过程中的pH变化曲线可知。a-b段发生的反应是二氧化硫和氢氧化钠反应生成亚硫酸钠,,离子方程式为SO2+2OH-=SO32-+H2O;d点时溶液中溶质为NaHSO3,溶液显酸性,离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);当NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则Ka=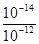 =10-2mol/L。
=10-2mol/L。
考点:反应热的计算,平衡常数的计算,离子方程式的书写,离子浓度大小的比较
本题难度:困难
4、选择题 在25℃时物质的量浓度为1 mol/L的(NH4)2SO4、(NH4)2SO3、(NH4)2Fe(SO4)2的溶液中,其c(NH4)分别为a、b、c(单位为mol/L),下列说法正确的是
A.a=b=c
B.a>b>c
C.a>c>b
D.c>a>b
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系或说法正确的是
A.0.1 mol·L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的顺序是:①>②>③>④
C.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b
参考答案:B
本 www.91eXam.org题解析:
本题难度:一般