微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法错误的是(???)
A.液氯能使干燥的有色布条褪色
B.氯气与其他物质发生反应后,氯元素化合价均变为-1价
C.新制氯水呈黄绿色是因为其中存在氯气
D.久置氯水遇AgNO3溶液会产生白色沉淀
参考答案:AB
本题解析:关键是抓住液氯与氯水(新制的和长久放置的)在组成成分上的不同,根据其各自所含的物质(粒子)推知其应具有什么性质,便可作出判断,液氯中并无水,不会形成次氯酸,干燥有色布条不会褪色,当氯气与水或碱反应时,除了生成-1价态化合物外,还有+1价态化合物。根据新制氯水和久置氯水的不同组成,可知C、D说法是正确的。
本题难度:简单
2、选择题 实验室制取时,要收集干燥纯净的氯气,应使氯气依次通过
A.水、浓H2SO4
B.饱和Na2CO3溶液、浓H2SO4
C.饱和NaCl溶液、浓H2SO4
D.饱和NaHCO3溶液、浓H2SO4
参考答案:C
本题解析:实验室制取的氯气中含有氯化氢和水蒸气,所以要得到干燥的氯气,一个依次通过饱和双氧水和浓硫酸的洗气瓶,答案选C。
本题难度:简单
3、填空题 (11分)物质的分类方法有多种。如根据同一种物质可能属于不同类别进行分类,也可用归纳、比较等方法对物质进行分类等,完成下列题目。
(1)现有①氧气、②空气、③碱式碳酸铜、④氯酸钾、⑤硫、⑥水、⑦氧化镁、⑧氯化钠、⑨氯水、⑩纯醋酸(CH3COOH)、?硫酸钡、?乙醇、?铜等物质。
其中属于单质的有________,属于化合物的有________,其中________属于含氧化合物,________属于氧化物,属于混合物的有________,属于电解质的是________,属于非电解质的有________(均填序号)。
(2)今有下列两组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。两组物质分别为:
①O2、Cl2、S、N2
②Fe、Na、Al、Si
组别
| 被选出的物质
| 分类依据
|
第①组
| ?
| ?
|
第②组
| ?
| ?
?
参考答案:
(1)①⑤? ③④⑥⑦⑧⑩?? ③④⑥⑦⑩?? ⑥⑦
本题解析:(1)考查同学们对元素化合物知识分类的系统掌握和应用。特别注意两点:①氧化物与含氧化合物的区别;②电解质与非电解质都属于化合物范畴。
(2)考查同学们对于一些常见单质的物理性质和化学性质等方面的异同点的掌握情况,从而对不同物质进行分类。
本题难度:一般
4、简答题 (12分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
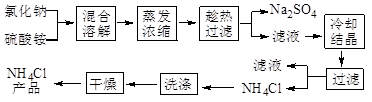
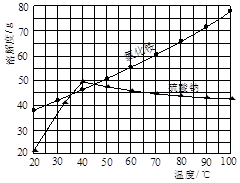
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式:???????????????????????????????????????。
(2)实验室进行蒸发浓缩用到的主要仪器有????????、带铁圈的铁架台、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是??????????????。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处?????????????????????;
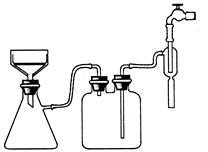 ????? ?????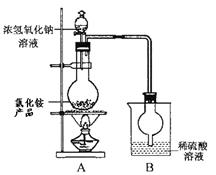
图1???????????????????????????????图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体?????。
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
(5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图2装置进行实验,充分反应后,测得B装置增重3.4g。则该粗产品中含氮的质量分数为???????????。
参考答案:(1)???(NH4)2SO4+2NaCl ===2NH4C
本题解析:(1)根据反应物和生成物可知,方程式为(NH4)2SO4+2NaCl ===2NH4Cl↓+ Na2SO4。
(2)蒸发浓缩用到的主要仪器是蒸发皿。
(3)由于温度降低,会析出晶体,所以为防止温度降低氯化铵晶体析出而损失,需要趁热过滤。根据装置可判断,错误之处在于布氏漏斗的颈口斜面未与吸滤瓶的支管口相对。
(4)溶液浓度较高或溶质溶解度太小,都不利于得到较大的晶体,答案选AD。
(5)B装置增重3.4g,则生成氨气是3.4g,其物质的量是3.4g÷17g/mol=0.2mol,因此该粗产品中含氮的质量分数为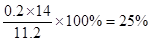 。 。
本题难度:一般
5、实验题 (本题16分)Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
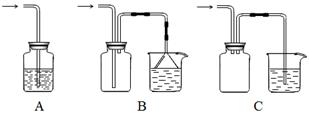
(1)下列装置适合作尾气吸收的是????????(填序号)。
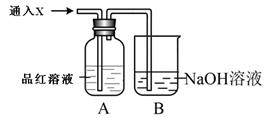
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是___________(至少填两种)如果要证明X是SO2气体,接下来的操作是:________________________________
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,_________后,再滴入几滴植物油;
(2)选择装置___________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
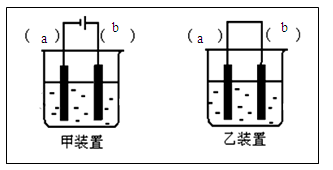
(3)在你选择的装置上标明电极材料分别为____________、________________
(4)实验中可在___________看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是______________
参考答案:
Ⅰ.(1)BC(2分)
(2)SO2、Cl2(
本题解析:
试题分析:
Ⅰ.(1)本题答题要从防止倒吸的角度去想。
(2)能使品红褪色的可马上想到SO2,再细想一下还有Cl2、O3、ClO2,如果要证明通入的是二氧化硫,则要用试管取褪色后的溶液,用酒精灯进行加热,看是否能恢复颜色;本题答题时一定要有操作、现象、结论
Ⅱ.本题要注意目的为了制备Fe(OH)2,观察其颜色,所以关键是所用的试剂要除O2,装置要隔绝空气,(1)溶液要除氧气则用加热煮沸的方法,温度升高,气体在水是的溶解度下降(2)甲和乙装置的区别在于有无外接电源,做这种题是二选一的情况,可以用假设选用一装置,代入题意;从本题的角度,可知要产生二价铁离子,再和氢氧根离子反应,所以要选用电解池,即甲装置;b电极为阳极产生二价铁离子则为Fe,a电极为石墨;因为阳极上产生二价铁离子,所以白色沉淀在阳极的附近可观察到,如果要想白色沉淀转化为红褐色沉淀,则要加入氧化剂,从题意中不能加入,但如果将电极反接,相当于用惰性电极电解氢氧化钠溶液,即电解水,氧气就可产生了,也就实现了转化。
本题难度:一般
|