微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是
A.次磷酸的电离方程式为H3PO2 3H++PO23-
3H++PO23-
B.次磷酸中P的化合价为+1
C.NaH2PO2是酸式盐
D.NaH2PO2溶液显弱酸性
参考答案:B
本题解析:
试题分析:次磷酸(H3PO2)是 一元中强酸,电离方程式应该用等号,而且只能电离产生1个H+,电离方程式是:H3PO2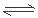 H++H2PO2-,错误;B.根据在化合物中元素的正负化合价的代数和为0的原则,结合H的化合价是+1价,O的化合价是-2价,可知在次磷酸中P的化合价为+1,正确;C.由于次磷酸(H3PO2)是 一元中强酸,所以NaH2PO2是正盐,错误;D.NaH2PO2是强碱弱酸盐,弱酸根离子H2PO2-水解消耗水电离产生的H+,破坏了水的电离平衡,最终当溶液达到平衡时,c(OH-)>c(H+),所以溶液显弱碱性,错误。
H++H2PO2-,错误;B.根据在化合物中元素的正负化合价的代数和为0的原则,结合H的化合价是+1价,O的化合价是-2价,可知在次磷酸中P的化合价为+1,正确;C.由于次磷酸(H3PO2)是 一元中强酸,所以NaH2PO2是正盐,错误;D.NaH2PO2是强碱弱酸盐,弱酸根离子H2PO2-水解消耗水电离产生的H+,破坏了水的电离平衡,最终当溶液达到平衡时,c(OH-)>c(H+),所以溶液显弱碱性,错误。
考点:考查次磷酸中元素的化合价、溶液的酸碱性、电离方程式的书写及盐的分类判断的知识。
本题难度:一般
2、实验题 (10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一?配制醋酸溶液的浓度取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
配制250 mL 0.2 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和_________________。
实验二?探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度(mol/L)
| 0.0010
| 0.0100
| 0.0200
| 0.1000
| 0.2000
|
pH
| 3.88
| 3.38
| 3.23
| 2.88
| 2.73
?回答下列问题:
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_______________________________________________________________________________
_____________________________________________ ____________________________________ ____________________________________
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度____________。
(填增大、减小或不变)
实验三?探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案_________________________
_____________________________________________。
参考答案:
(10分,每空2分)(1)胶头滴管? 250mL容量
本题解析:略
本题难度:一般
3、选择题 pH=2的A.B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是
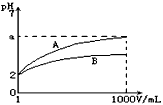 [???? ] [???? ]
A.A.B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A.B都是弱酸,则5≥a>2
参考答案:C
本题解析:
本题难度:一般
4、选择题 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是(???)
A.c(HCOO-)< c(Na+)
B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-)
D.c(OH-)> c(HCOO-)
参考答案:BC
本题解析:略
本题难度:一般
5、选择题 下列叙述正确的是( )
A.在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.pH=3的盐酸与pH=11的氨水等体积混合,混合溶液呈酸性
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.若1?mL?pH=1的盐酸与100?mL?NaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11
参考答案:D
本题解析:
本题难度:简单
|