微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2?→ HN3(叠氮酸) + H2O (未配平);
+ HNO2?→ HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为?????,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为????????????。
⑵联氨的电子式为??????????????。
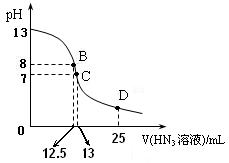
⑶上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
① D点时溶液中各离子的浓度由大到小的顺序为?????
D点时溶液中各离子的浓度由大到小的顺序为?????
② B点时溶液中c  (HN3
(HN3 ) =????????????????
) =????????????????
参考答案:(10分,每空2分)
(1)0.1mol;?? 2Na
本题解析:略
本题难度:一般
2、选择题 已知下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s)??△H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s)??△H= -Q2 KJ/mol
且Q1>Q2,则不正确的是(??)
A.燃烧白磷放出的能量比燃烧红磷放出的能量多
B.白磷转化为红磷是属于放热反应
C.白磷和红磷互为同素异形体
D.等质量的白磷和红磷,白磷含有的能量比红磷的低
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (6分)实验室常加热氯化铵与氢氧化钙固体制取氨气,写出该反应的化学方程式:?????????????????????????,可用????????????????????????来检验氨气,现要制得2.24L(标况)氨气,理论上需要氯化铵固体????????????g。(相对原子质量:N-14? H-1 Cl-35.5)
参考答案: 本题解析:反应的化学方程式:2NH4Cl+Ca(OH)2
本题解析:反应的化学方程式:2NH4Cl+Ca(OH)2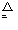 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
检验氨气: 湿润的红色石蕊试纸(或蘸有浓盐酸的玻璃棒)
要制得2.24L(标况)氨气即0.1mol,理论上需要氯化铵固体0.2mol,即5.35g。
本题难度:一般
4、选择题 在常温常压下,a, b,c,d 四支相同的试管中,分别装入以等物质的量混合的两种气体。a试管内是NO2和O2,b试管内是C12和SO2,c试管内是NO和O2,d试管内是O2和H2。将四支试管迅速同时倒立于水中,最终水面上升高度h的比较,正确的是
A.hb>hc>ha>hd
B.hc>ha>hb>hd
C.hd>ha>hc>hb
D.hb>ha>hc>hd
参考答案:A
本题解析:设气体的物质的量都是4mol,则a试管内发生的反应是4NO2+O2+2H2O=4HNO3,所以剩余气体是3mol。b试管内反应是Cl2+SO2+H2O=2HCl+H2SO4,剩余气体是0。C试管内反应是4NO+3O2+2H2O=4HNO3,所以剩余气体是1mol。D试管内气体不反应,剩余气体8mol,所以答案选A。
本题难度:简单
5、选择题 6.4g铜与过量的硝酸(8mol / L,60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+为 n mol,此时溶液中所含NO3–物质的量为
A.0.28mol
B.0.31mol
C.(n + 0.2) mol
D.(n + 0.4) mol
参考答案:C
本题解析:6.4g的物质的量为:6.4g÷64g/mol=0.1mol
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1?????????? 2
0.1mol?????? x
1/2=0.1/x
解得x=0.2mol,
HNO3--H+--NO3-
1??? 1
nmol??? ymol
y=nmol,
则此时溶液中含有NO3-的物质的量为(0.2+n )mo
本题难度:一般