微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 Ⅰ:由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0
(1)该反应平衡常数K的表达式为______.温度降低,平衡常数K______(填“增大”、“不变”或“减小”).
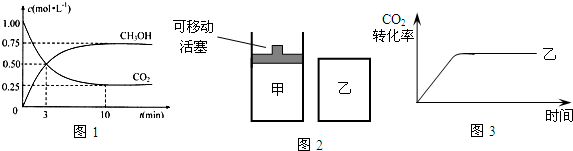
(2)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为______.
(3)下列措施中能使n(CH3OH)/n(CO2)增大的有______.
A.升高温度;B.加入催化剂;C.将H2O(g)从体系中分离;D.再充入1mol CO2和3mol H2;
E.充入He(g),使体系总压强增大.
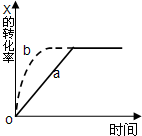
(4)如图2所示,在甲、乙两容器中分别充入物质的量之比为1:3的CO2和H2,使甲、乙两容器初始容积相等.在相同温度下发生反应,并维持反应过程中温度不变.甲和乙相比,转化程度更大的是______,且知乙容器中CO2的转化率随时间变化的图象如图3所示,请在图3中画出甲容器中CO2的转化率随时间变化的图象.并请说明以CO2为原料生产燃料甲醇的优点是______(写出一条即可).
Ⅱ:一定常温下,FeS的KSP=2.5×10-18,H2S饱和溶液在该温度下,[H+]与[S2-]存在着以下关系:[H+]2?[S2-]=1.0×10-21.在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为______(用对数形式表示).(写出计算过程)
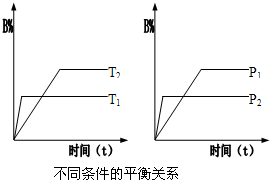
2、选择题 如图曲线a表示放热反应?X(g)+Y(g)?Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
3、选择题 已知某可逆反应:mA(g)+nB(g)?pC(g)△H?在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
A.T1<T2,p1>p2,m+n<p,△H>0
B.T1>T2,p1<p2,m+n<p,△H<0
C.T1>T2,p1<p2,m+n>p,△H>0
D.T1>T2,p1>p2,m+n>p,△H<0
4、简答题 试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)??

?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/°C | 400 | 500 | 800
平衡常数K
9.94
9
1
若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol?L-1,在该条件下,CO的平衡转化率为______.
(2)在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s | 0 | 20 | 40 | 60 | 80
n(NO2)/mol
0.40
n1
0.26
n3
n4
n(N2O4)/mol
0.00
0.05
n2
0.08
0.08
①n3______n4(填“>”或“<”或“=”),该反应的平衡常数的值为______;
②若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol?L-1,假设在80s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)以甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的正极反应式______.
5、选择题 关于化学平衡常数的叙述中,正确的是?
[???? ]
A.只与化学方程式本身和温度有关
B.只与反应的温度有关
C.与化学反应本身和温度有关,并且会受到起始浓度的影响
D.只与化学反应本身有关,与其他任何条件无关的一个不变的常数
|
|
网站客服QQ: 960335752 - 14613519 - 791315772