微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
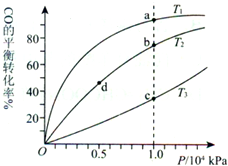
1、选择题 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c) υ(b)>υ(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
2、简答题 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2?(g),CO和H2O浓度变化如图,
| 时间(min) | CO | H2O | CO2 | H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
C1
C2
C3
C3
4
C1
C2
C3
C3
5
0.116
0.216
0.084
6
0.096
0.266
0.104
(1)该反应的平衡常数表达式为K=______;
(2)已知上述反应为放热反应,则其反应热△H______零(填“大于”、“小于”或“等于”);??升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min-4min之间反应处于______状态;???C1数值______0.08mol/L?(填大于、小于或等于).
②反应在4min-5min间,平衡向逆反应方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.增加水蒸气????????????????????????b.降低温度
c.使用催化剂????????????????????????d.增加氢气浓度.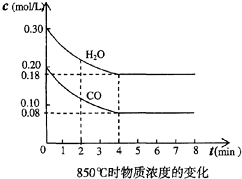
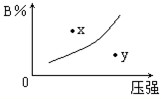
3、选择题 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
①m+n>p;②x点表示该反应的正反应速率大于逆反应速率;
③n>p;???④x点时比y点时的反应速率慢.
A.只有①
B.只有②④
C.只有①②④
D.只有①和③
4、简答题 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)? 催化剂
△
?2SO3(g).某温度下,SO2的平衡转化率与体系总压强(p)的关系如图所示.根据图示回答下列问题:
①将2.0mol?SO2和1.0mol?O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于______.
②平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”).
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
若用标准状况下4.48L?CH4还原NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ.
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去.转化流程如图所示:
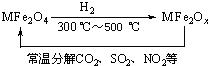
请写出MFe2Ox分解SO2的化学方程式______(不必配平).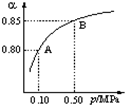
5、填空题 已知2X2(g)+Y2(g)?2Z(g)△H=-akJ?mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol?L-1,放出热量bkJ.
(1)此反应平衡常数表达式为______;若将温度降低到300℃,则反应平衡常数将______(填增大、减少或不变).
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量ckJ,则Z浓度______W mol?L-1(填“>”、“<”或“=”),a、b、c之间满足关系______(用代数式表示).
(3)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2molX2和1molY2达到平衡后,Y2的转化率将______(填“变大”、“变小”或“不变”).
|
网站客服QQ: 960335752 - 14613519 - 791315772