微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各个装置中能组成原电池的是[???? ]
A.
B.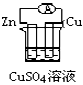
C.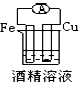
D.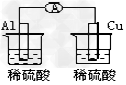
2、选择题 在室温下,1L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO3- | Cl-
C(mol/L)
1
1
4
a
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电解产物可能存在的溶解现象)下列说法不正确的是( )
A.电解后溶液的PH=0
B.阳极与阴极析出的气体物质的量之比为2:1
C.阴极析出64g铜
D.阳极电解反应:2Cl--2e-=Cl2↑
3、计算题 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)?△H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1="+489.0" KJ·mol-1
②C(石墨)+CO2(g)=2CO(g) △H2=+172.5KJ·mol-1
则△H=???KJ?mol-1。
(2)高炉炼铁反应的平衡常数表达式K=???,温度升高后,K值???(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
?
| Fe2O3
| CO
| Fe
| CO2
| 甲/mol
| 1.0
| 1.0
| 1.0
| 1.0
| 乙/mol
| 1.0
| 2.0
| 1.0
| 1.0
?
①甲容器中CO的平衡转化率为???。
②下列说法正确的是???(填字母)。
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2??
D.增加Fe2O3的量可以提高CO的转化率
(4)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为???。
4、选择题 如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是
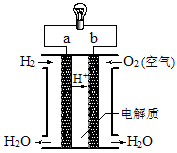
A.a极是负极
B.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池
5、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
周期
| ⅠA
|
| 0
| 1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
| 2
|
|
|
| ②
| ③
| ④
|
|
| 3
| ⑤
|
| ⑥
|
|
| ⑦
| ⑧
|
(1)请画出元素⑥的离子结构示意图: 。
(2)元素⑦中质子数和中子数相等的同位素符号是: 。
(3)④、⑤、⑦的离子半径由大到小的顺序为: 。
(4)②的最高价氧化物对应水化物的电离方程式为: 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: 。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: 。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式: 。
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772