微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把一瓶不饱和的烧碱溶液分成两等份,保持温度不变,向两份溶液中分别加入一定量的Na2O2、Na2O,使溶液恰好饱和,下列不合理的是
A.加入的Na2O2?和Na2O的质量相等
B.加入的Na2O2?和Na2O的物质的量相等
C.加入的Na2O2?和Na2O的质量之比为78:62
D.所得两份饱和溶液中溶质的物质的量相同
参考答案:A
本题解析:分析:发生反应2Na2O2+2H2O═4NaOH+O2↑,Na2O+H2O═2NaOH,由方程式可知,相同物质的量的Na2O2和Na2O的消耗相同物质的量的水,生成相同物质的量的NaOH,保持温度不变,使溶液恰好饱和,故加入的Na2O2、Na2O的物质的量相等,据此结合选项分析解答.
解答:发生反应2Na2O2+2H2O═4NaOH+O2↑,Na2O+H2O═2NaOH,由方程式可知,相同物质的量的Na2O2和Na2O的消耗相同物质的量的水,生成相同物质的量的NaOH,保持温度不变,使溶液恰好饱和,故加入的Na2O2、Na2O的物质的量相等,
A、由上述分析可知,加入的Na2O2、Na2O的物质的量相等,二者摩尔质量不相等 ,故加入质量不相等,故A错误;
B、由上述分析可知,加入的Na2O2、Na2O的物质的量相等,故B正确;
C、加入的Na2O2、Na2O的物质的量相等,故加入Na2O2、Na2O的质量之比等于摩尔质量之比为78g/mol:62g/mol=78:62,故C正确;
D、加入加入的Na2O2、Na2O的物质的量相等,生成相同物质的量的NaOH,所得两份饱和溶液浓中氢氧化钠的物质的量相同,故D正确;
故选A.
点评:本题考查钠的重要化合物、化学计算等,难度中等,关键是根据方程式判断两反应中消耗的水以及生成氢氧化钠的量的关系.
本题难度:一般
2、选择题 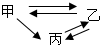 下列物质之间的相互转化不符合?(“→”表示一步反应的是)
下列物质之间的相互转化不符合?(“→”表示一步反应的是)
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:A.SiO2不能与水反应生成H2SiO3;
B.CH3CH2OH可与HBr发生取代反应生成CH3CH2Br,CH3CH2Br发生消去反应可生成CH2═CH2,CH2═CH2与HBr加成反应生成CH3CH2Br,CH3CH2Br水解可生成CH3CH2OH;
C.结合两性氢氧化物的性质进行分析,该转化可以实现;
D.HClO可与HCl反应生成Cl2,Cl2与H2反应可生成HCl,HCl被氧化可生成Cl2,Cl2与水反应可生成HClO.
解答:A.SiO2不能一步反应生成H2SiO3,可先与NaOH反应生成Na2SiO3,然后和酸反应可生成H2SiO3,故A选;
B.CH3CH2OH可与HBr发生取代反应生成CH3CH2Br,CH3CH2Br发生消去反应可生成CH2═CH2,CH2═CH2与HBr加成反应生成CH3CH2Br,CH3CH2Br水解可生成CH3CH2OH,可一步转化,故B不选;
C.可通过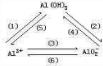 实现,其中(1)(2)(3)为碱性条件,(4)(5)(6)为酸性条件,故C不选;
实现,其中(1)(2)(3)为碱性条件,(4)(5)(6)为酸性条件,故C不选;
D.HClO可与HCl反应生成Cl2,Cl2与H2反应可生成HCl,HCl被氧化可生成Cl2,Cl2与水反应可生成HClO,可一步转化,故D不选.
故选A.
点评:本体考查常见无机物的性质及转化,题目难度不大,全面掌握常见物质的性质为解答该题题目的关键,学习中注意积累.
本题难度:困难
3、选择题 类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中正确的是
A.由2Cu+O2??2CuO可推出Cu+S?CuS
B.相同温度下,CaCO3的溶解度比Ca(HCO3)2的溶解度小,则Na2CO3的溶解度也小于NaHCO3的溶解度
C.Mg能在CO2中燃烧,所以Na也能在CO2中燃烧
D.CO2与Na2O2反应生成Na2CO3和O2,故SO2与Na2O2反应生成Na2SO3和O2
参考答案:C
本题解析:分析:A、铜和硫反应生成Cu2S不是硫化铜;
B、碳酸钠溶解度大于碳酸氢钠的溶解度;
C、Na性质比Mg更活泼,还原性更强,可在CO2中燃烧;
D、SO2与Na2O2发生氧化还原反应生成Na2SO4.
解答:A、S的氧化性较弱,与Cu反应生成Cu2S,故A错误;
B、由于碳酸钠溶解度大于碳酸氢钠的溶解度,类推不成立,故B错误;
C、Na性质比Mg更活泼,还原性更强,可在CO2中燃烧,但反应为4Na+3CO2=2Na2CO3+C,故C正确
D、SO2与Na2O2发生氧化还原反应生成Na2SO4,没有氧气生成,故D错误
故选C.
点评:本题考查金属及其化合物的性质,把握物质的性质是解答该题的关键,本题难度中等.
本题难度:一般
4、选择题 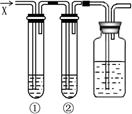 如图所示,若向盛有溶液①和溶液②的试管中,通入过量气体X,最终①、②均有沉淀生成的是
如图所示,若向盛有溶液①和溶液②的试管中,通入过量气体X,最终①、②均有沉淀生成的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.根据Cl2具有氧化性,能氧化亚硫酸根离子、硫离子来分析;
B.根据SO2通入水中生成H2SO3,溶液呈酸性,强酸可以制弱酸,H2SO3与Na2SiO3反应可得硅酸沉淀,另外NO3-在酸性条件下具有强氧化性,可与H2SO3发生氧化还原反应生成SO42-,SO42-与Ba2+结合生成BaSO4;
C.根据NH3通入水中生成氨水,溶液呈碱性,少量氨水与AgNO3溶液反应生成沉淀,氨水过量,沉淀溶解;少量氨水与AlCl3溶液反应生成沉淀,氨水过量,沉淀不溶解;
D.根据HCl通入水中形成盐酸,溶液呈酸性,盐酸与CuSO4不反应,少量盐酸与NaAlO2溶液反应生成氢氧化铝沉淀,盐酸过量沉淀溶解;
解答:A.因Cl2具有氧化性,能氧化亚硫酸根离子生成硫酸根离子,氧化硫离子生成单质硫,最终①无沉淀,②有沉淀,故A错误;
B.因SO2通入水中生成H2SO3,H2SO3与Na2SiO3反应可得硅酸沉淀,另外NO3-在酸性条件下具有强氧化性,可与H2SO3发生氧化还原反应生成SO42-,与Ba2+结合生成BaSO4,最终①有沉淀,②有沉淀,故B正确;
C.因NH3通入水中生成氨水,溶液呈碱性,少量氨水与AgNO3溶液反应生成沉淀,氨水过量,沉淀溶解;少量氨水与AlCl3溶液反应生成沉淀,氨水过量,沉淀不溶解,最终①无沉淀,②有沉淀,故C错误;
D.因盐酸与CuSO4不反应,少量盐酸与NaAlO2溶液反应生成氢氧化铝沉淀,盐酸过量沉淀溶解,最终①无沉淀,②有沉淀,故D错误;
故选:B.
点评:本题主要考查了物质的性质,尤其是化学方程式的书写,需要注意的是有些反应中反应物的量的不同会影响产物的种类,平时要积累.
本题难度:困难
5、选择题 a?gMg-Al合金完全溶解在c1?mol/L、V1LHCl溶液中,产生bmolH2.再向反应后的溶液中加入c2mol/L、V2LHCl溶液,恰好使沉淀达到最大值,且沉淀质量为dg.下列关系不正确的是
A.d=a+34b
B.c1V1=c2V2
C.Al的质量g
D.与金属反应后剩余HCl为(c1V1-2b)mol
参考答案:C
本题解析:分析:A、根据金属、氢气和沉淀之间的关系式得沉淀质量=金属质量+氢氧根质量.
B、根据恰好使沉淀达到最大值,且沉淀质量为dg.反应后溶液的成分为NaCl,根据酸和碱以1:1反应判断酸和碱的物质的量之间的关系.
C、设合金中含有xmolMg,ymolAl,根据生成氢气的物质的量和金属的质量可列方程组计算合金中镁和铝的物质的量,根据镁和铝的物质的量金属其质量;
D、总盐酸的物质的量减去生成氢气所用盐酸的物质的量即为剩余盐酸的物质的量.
解答:设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生b?mol?H2,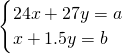 ,所以
,所以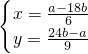 .
.
A、再向反应后的溶液中加入C2mol?L-1、V2L?NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg,
根据Mg~H2~Mg(OH)2,Al~1.5H2~Al(OH)3,反应生成沉淀的质量等于金属的质量加氢氧根离子的质量,而氢氧根离子的物质的量等于2n(H2),则d=a+2b×17=a+34b,故A正确.
B、反应后溶液的成分为NaCl,则C1×V1=C2×V2,故B正确.
C、铝的质量为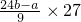 =3(24b-a)g,故C错误.
=3(24b-a)g,故C错误.
D、生成bmolH2,则消耗盐酸2bmol,则剩余HCl为(c1V1-2b)mol,故D正确.
故选C.
点评:本题考查混合物的计算,题目难度较大,本题利用守恒的方法计算.
本题难度:困难