微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知
⑴ H2(g)+1/2 O2(g)====H2O(g) ; △H1=a kJ·mol-1
⑵ 2H2(g)+ O2(g)===2H2O(g) ; △H2=b kJ·mol-1
⑶ H2(g)+1/2O2(g)====H2O(l) ; △H1=c kJ·mol-1
⑷ 2H2(g)+ O2(g)===2H2O(l) ; △H2=d kJ·mol-1
下列关系式中正确的是[???? ]
A.a<b<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般
2、填空题 (14分)(1)常温下物质的量浓度相同的aHF、bNH3·H2O、c H2S溶液,电离常数分别为7.2
参考答案:
本题解析:
本题难度:一般
3、填空题 铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=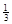 Na3AlH6 (s)+
Na3AlH6 (s)+ 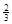 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) +  H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) + H2(g) ΔH= 。
H2(g) ΔH= 。

(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
参考答案:(9分)(1)常温下,铝易被浓硝酸、浓硫酸钝化
(2)
本题解析:
试题分析:(1)常温下,铝易被浓硝酸、浓硫酸钝化,所以浓硝酸、浓硫酸可贮存在铝制容器中。
(2)根据反应的方程式可知,铝元素的化合价从+3价降低到0价,得到电子,发生还原反应,所以氧化剂是LiAlH4、AlCl3 。
(3)根据盖斯定律可知,①+②×1/3,即得到反应式NaAlH4(s)=" NaH(s)" + Al (s) + H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
(4)①原电池中正极得到电子,则根据总的反应式可知Al失去电子,做负极,所以正极反应式是3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)。
②普通锌锰干电池中负极是锌,65g锌失去2mol电子,而65g铝失去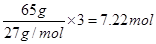 电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
③铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑。
考点:考查铝的性质、用途、反应热、电极反应式的书写以及有关计算
点评:该题是中等难度的试题,试题设计新颖,基础性强,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲,也有利于培养学生的规范答题能力和逻辑推理能力,提高学生的学习效率。
本题难度:困难
4、填空题 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO NO2
NO2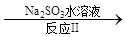 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
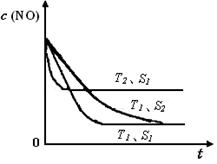
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
参考答案:(1)CH4 (g)+2NO2(g)=N2(g)+CO2(g
本题解析:
试题分析:(1)将已知的两个热化学方程式相加除以2即得,答案为CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol
(2)提高氮氧化物的转化率即使反应正向进行,根据勒夏特列原理,可采取增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施;
(3)反应Ⅱ中反应物为NO2、Na2SO3,产物之一有N2,根据氧化还原反应理论,可推断另一产物为Na2SO4化学方程式是2NO2 + 4 Na2SO3 = N2 + 4 Na2SO4;若生成11.2 L N2(标准状况),其物质的量为0.5mol,消耗NO2的物质的量为1mol,从而可计算出消耗ClO2的质量为67.5g;
(4)根据化学平衡中的“先拐先平”规律,温度高的先达平衡,表面积大的速率快,先达平衡,所以T2>T1,S1>S2,随温度升高,CO的浓度增大,说明升温平衡逆向移动,正向是放热反应△H<0。
考点:考查盖斯定律的应用、平衡移动与外界条件的关系、化学方程式的推断及计算、化学平衡图像的分析能力
本题难度:困难
5、填空题 (12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
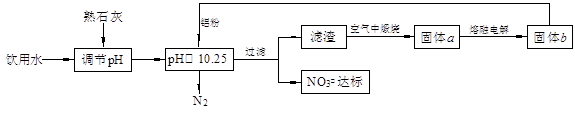
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 。
(2)该方案中选用熟石灰调节pH,理由是 、 ,在调节pH时,若pH过大或过小都会造成 的利用率降低。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 _。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
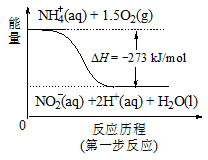
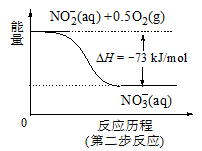
试写出1 mol NH4+ (aq)全部氧化成NO3-(aq)的热化学方程式是 。
参考答案:(1)10Al + 6NO3- + 18H2O==10Al(
本题解析:
试题分析:(1)根据题意,在含有NO3-的碱性溶液中加入铝粉,会发生氧化还原反应,结合电子守恒、原子守恒及电荷守恒,可得反应的离子方程式为10Al + 6NO3- + 18H2O==10Al(OH)3 + 3N2↑+ 6OH-;(2)该方案中选用熟石灰调节pH,理由是引入的Ca2+对人体无害,而且熟石灰的来源丰富、价格便宜;在调节pH时,若pH过大或过小都会造成Al发生反应产生氢气,导致Al的利用率降低。(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,说明氧化产物是水,还原产物是N2,则催化还原法的离子方程式为5H2 + 2NO3 N2 + 4H2O + 2OH-;(4)根据图示可知1 mol NH4+ (aq)全部氧化成NO3-(aq)放出热量是346 kJ,所以该反应的热化学方程式是NH4+ (aq) + 2O2(g)==2H+(aq) + NO3- (aq) + H2O(l) △H=-346 kJ/mol。
N2 + 4H2O + 2OH-;(4)根据图示可知1 mol NH4+ (aq)全部氧化成NO3-(aq)放出热量是346 kJ,所以该反应的热化学方程式是NH4+ (aq) + 2O2(g)==2H+(aq) + NO3- (aq) + H2O(l) △H=-346 kJ/mol。
考点:考查含NO3-的污水的处理方法的离子方程式的书写、化学试剂的选择、热化学方程式的书写的知识。
本题难度:困难