微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在配置Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
A.NaOH
B.H2SO4
C.KCl
D.CH3COOH
参考答案:B
本题解析:
试题分析:硫酸铁水解生成氢氧化铁和硫酸,为抑制水解,加少量硫酸。
考点:盐类水解的应用
点评:配制氯化铁溶液时,为防止水解,可将氯化铁溶液溶于盐酸,再加水稀释到所需浓度。
本题难度:一般
2、选择题 下列根据反应原理设计的应用,不正确的是( )
A.CO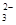 +H2O
+H2O HCO
HCO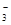 +OH- 与Al2(SO4)3溶液混合作灭火剂
+OH- 与Al2(SO4)3溶液混合作灭火剂
B.Al3++3H2O Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)  TiO2·xH2O↓+4HCl 制备TiO2纳米粉
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2O Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸
参考答案:A
本题解析:
试题分析:A.泡沫灭火剂的原料是硫酸铝和碳酸氢钠反应生成氢氧化铝沉淀和二氧化碳起到灭火作用,而不是碳酸钠,因为生成等量的二氧化碳时,碳酸钠消耗的硫酸铝多、产生二氧化碳的速率慢,A原理错误;B.明矾溶于水,Al3+发生水解生成Al(OH)3胶体,能够吸附水中悬浮物,故B正确;C、四氯化钛可以和水之间发生反应:TiCl4+(x+2)H2O(过量)
本题难度:一般
3、选择题 一定温度下,向300 mL l mol/L的NaOH溶液中通入bmol CO2,下列说法正确的是
A.通入CO2过程中溶液中的Kw减小
B.b=0.3与b=0.15时,所得溶液中的微粒种类不相同
C.当b=0.2时,所得溶液中部分离子浓度关系为:c(HCO3一)>c(CO32-)>c(OH-)>c(H+)
D.当恰好生成NaHCO3时,溶液中存在:c(Na+ )+c(H十)=c(HCO3-)+c(OH一)
参考答案:C
本题解析:
试题分析:A、水的离子积常数只与温度有关,所以通入二氧化碳的过程中,Kw不变,错误;B、b=0.3和b=0.15时,所得溶液不同,但溶液中的微粒的种类完全相同,都是含有Na+、HCO3一、CO32-、OH-、H+、H2O、H2CO3,错误;C、300mL1mol/L的氢氧化钠溶液中NaOH的物质的量是0.3mol,所以通入0.15mol二氧化碳时,生成碳酸钠,当通入0.2mol二氧化碳时,则生成0.1mol碳酸钠和0.1mol的碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,所以溶液中的离子浓度关系是c(HCO3一)>c(CO32-)>c(OH-)>c(H+),正确;D、当恰好生成NaHCO3时,溶液中仍存在Na+、HCO3一、CO32-、OH-、H+,根据电荷守恒,溶液中存在:c(Na+ )+c(H十)=c(HCO3-)+c(OH一)+2 c(CO32-),错误,答案选C。
考点:考查二氧化碳与氢氧化钠溶液反应中溶液中离子浓度变化关系的判断
本题难度:一般
4、选择题 下列物质能发生消去反应且只能得到一种单烯烃的是( ? )
A.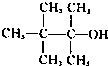
B.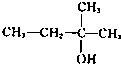
C.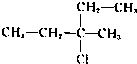
D.
参考答案:A
本题解析:
本题难度:简单
5、选择题 在Na2S溶液中,下列关系不正确的是
A.c(Na+)=2c(HS—)+2c(S2—)+c(H2S)
B.c(Na+)+c(H+)=c(OH—)+c(HS—)+2c(S2—)
C.c(Na+)>c(S2—)>c(OH>c(HS—)
D.c(OH—)=c(HS—)+c(H+)+2c(H2S)
参考答案:A
本题解析:
试题分析:Na2S溶液中存在的三种守恒,电荷守恒守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),物料守恒:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+);质子守恒:c(H+)+2c(H2S)+c(HS-)=c(OH-),A、根据物料守恒,c(H2S)前面缺少2,错误;B、是电荷守恒,正确;C、Na2S是强碱弱酸盐,S2-水解的反应方程式:S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-,水解程度非常微弱,多元弱酸根的水解第一步为主,离子浓度大小顺序:c(Na+)>c(S2—)>c(OH>c(HS—),正确;D、是质子守恒,正确。符合题意的是A选项。
H2S+OH-,水解程度非常微弱,多元弱酸根的水解第一步为主,离子浓度大小顺序:c(Na+)>c(S2—)>c(OH>c(HS—),正确;D、是质子守恒,正确。符合题意的是A选项。
考点:考查三个守恒及离子浓度大小。
本题难度:一般