微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (20分)硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。

①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。

②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化: 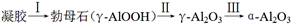 。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:

(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
参考答案:(20分)
(1)B(2分)
(2)2Al+6H
本题解析:
试题分析:(1)硝酸铝中氮元素的化合价为+5,处于最高价,所以硝酸铝具有氧化性,在实验室中,硝酸铝必须与可燃物分开存放,故B项正确。
(2)Al作电极电解HNO3溶液制取Al(NO3)3,阳极上Al失电子生成Al3+,阴极上H+得电子生成H2,所以电解反应的离子方程式为:2Al+6H+ 2Al3++3H2↑。
2Al3++3H2↑。
(3)[Al(OH)]2+结合H2O中的羟基可转化为[Al(OH)2]+,所以离子方程式为:[Al(OH)]2++H2O [Al(OH)2]++H+。
[Al(OH)2]++H+。
(4)①根据元素守恒和电荷守恒,可知所缺离子为阳离子且含有N元素,为NH4+,根据观察法可配平该离子方程式。
②溶液中含有Al3+,经搅拌Ⅱ,Al3+的水解程度增大,所以pH下降。
③加入(CH2)6N4后生成NH4+,所以溶液中含有NH4NO3,根据pH=3.95可得c(OH?)=10-14÷10-3.95=10-10.05,则c(Al3+)=Ksp[Al(OH)3]÷c(OH?)3=1.3×10-33÷(10-10.05)3=1.3×10-2.85mol?L?1>1×10-5 mol·L-1,所以溶液还含有Al(NO3)3。
④转化II由γ-AlOOH转化为γ-Al2O3,失重率=18÷120×100%=12%,根据图像可知对应的失重阶段是i;转化III有γ-Al2O3转化为α-Al2O3,根据图像可知对应的失重阶段是iii,开始温度是600℃。
考点:本题考查物质的性质及应用、电解原理、方程式的配平及书写、化学流程及图像的分析。
本题难度:困难
2、填空题 聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:

聚合过程主要利用了Al3+的性质是 。
参考答案:水解性
本题解析:略
本题难度:一般
3、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH4++)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+ c(H+)>c(Na+)+c(OH-)
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
参考答案:CD
本题解析:
试题分析:A、25℃时,pH=7的NH4Cl与NH3·H2O混合溶液呈中性,则有c(H+)=c(OH-),由电荷守恒式:c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)知c(NH4+)=c(Cl-),又弱电解质的电离和盐类的水解是微弱的则c(NH4+)=c(Cl-)> c(H+)=c(OH-),错误;B、0.1mol/LNa2S溶液中,根据质子守恒知c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C、25℃时,pH=2的HCOOH与pH=12的NaOH溶液中,c(HCOOH)>c(NaOH),等体积混合后HCOOH远过量,溶液为HCOOH和CH3COONa,呈酸性,结合电荷守恒式知c(HCOO-)+c(H+)>c(Na+)+c(OH-),正确;D、根据物料守恒得2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3(Na+),正确。
考点:考查溶液中离子浓度的大小关系及守恒规律的应用。
本题难度:困难
4、选择题 物质的量浓度相同的三种盐 NaX、NaY和NaZ的溶液,若它们的pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是
A.HX、HZ、HY
B.HZ、HY、HX
C.HX、HY、HZ
D.HY、HZ、HX
参考答案:C
本题解析:
试题分析:酸越弱,对应的盐的碱性越强,所以三种盐的碱性依次增强,说明对应的酸的酸性依次减弱,选C。
考点:盐类的水解程度的比较。
本题难度:一般
5、选择题 下列有关说法正确的是
A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
参考答案:A
本题解析:
试题分析:A项根据ΔG=ΔH-TΔS,该反应正反应ΔS<0,而ΔG<0,所以ΔH<0,A项正确。B当镀层破损后,均形成原电池,锡和铁的原电池中铁做负极,腐蚀,而锌和铁的原电池中锌为负极,铁不腐蚀,故B错误;C项CH3COOH溶液加水稀释后,CH3COOH的电离平衡向电离的方向移动,则n(CH3COO-)增大,但是由于体积变大,c(CH3COO-)减小,故C错误。D项Na2CO3溶液中加入少量Ca(OH)2固体,化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,生成NaOH,溶液pH增大,同时会抑制溶液中的CO32--的水解,因此CO32-水解程度会减小,但溶液的pH会增大。
考点:反应自发性的判据;金属的腐蚀和防护;弱电解质的电离平衡和盐类的水解平衡
本题难度:一般