微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,有浓度均为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,若测得其中c(NH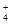 )分别为
)分别为
参考答案:
本题解析:
本题难度:一般
2、填空题 (6分)在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为 。
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,
理由是 。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是 。
参考答案:(1)中性 H++OH-=H2O(2
本题解析:
试题分析:(1)等浓度的一元强酸与一元强碱等体积混合,恰好反应生成强酸强碱盐,该盐溶液显中性,该反应的离子方程式为H++OH-=H2O;
(2)强酸电离出的H+浓度等于弱碱电离出的OH-,所以弱碱的浓度大于强酸,则等体积混合后溶液为强酸弱碱盐和弱碱的混合溶液,显碱性,原因是酸HA与碱MOH中和后,碱过量,还会电离出OH-;
(3)同浓度的一元强酸与一元弱碱等体积混合,恰好反应生成强酸弱碱盐,溶液呈酸性,出现这一现象的离子方程式M++H2O MOH+H+。
MOH+H+。
考点:考查溶液的酸碱性,溶液的PH,酸碱中和反应等知识。
本题难度:一般
3、选择题 在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列物质的溶液,可以得到该固体物质的是( )
A.氯化铝
B.碳酸氢钠
C.硫酸镁
D.高锰酸钾
参考答案:C
本题解析:AlCl3溶液加热蒸干并灼烧后得到Al2O3,因为AlCl3水解时生成HCl,盐酸为挥发性酸,在加热时挥发除去,将得到固体Al(OH)3,然后灼烧Al(OH)3分解,得到Al2O3。而碳酸氢钠和高锰酸钾在加热蒸干并灼烧过程中会发生分解反应。
本题难度:一般
4、填空题 氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
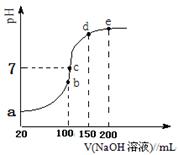
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
参考答案:(14分)
(1)C2H8N2(l)+2N2O4(l)
本题解析:
试题分析:(1)偏二甲肼(C2H8N2)和液态N2O4反应,生成无毒、无污染的气体氮气和水,已知1 g燃料完全燃烧释放出的能量为42.5 kJ,则1 mol燃料完全燃烧释放出的能量为2550 kJ,所以该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol 。
(2)①由图像可知看出c(N2O4 )="0.6" mol/L,N2O4的浓度为NO2的2倍,则c(NO2 )=0.3,298k时,该反应的平衡常数为0.6÷0.32 = 6.67。
②A.在恒容密闭容器中,混合气体的密度始终保持不变,不能说明反应处于平衡状态;B.NO2是红棕色气体,当反应向右进行时,混合气体的颜色变浅,当混合气体的颜色不再变化时,反应处于平衡状态;C.该反应是气体体积减小的可逆反应,压强随着反应的进行而减小,当气压恒定时,反应处于平衡状态,选A。
③在398K,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,该容器的体积为2 L,Q=0.6÷0.32=6.67,等于298K时的平衡常数,而该反应是放热反应,升高温度,K值减小,所以Q>K (398K),平衡逆向移动,则此时V(正)<V(逆)。
(3)①在b点,等浓度、等体积的NH4HSO4与NaOH溶液1:1恰好反应生成硫酸铵,溶液中发生水解反应的离子是NH4+ ;
②在c点,溶液呈中性,c(OH-)=c(H+)但最小,在b点溶液中含有等物质的量的Na+、NH4+ 、SO42-,该溶液因NH4+ 的水解而显酸性,要想使溶液呈中性,需再加NaOH到c点,所以溶液中各离子浓度由大到小的排列顺序为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
③d点是硫酸铵和氨水的混合溶液,氨水的浓度较大,对水的电离抑制程度较弱,e点是硫酸钠与氨水的混合溶液,氨水的浓度较大,对水的电离抑制程度较大,所以d、e点对应溶液中,水电离程度大小关系是d>e。
考点:考查热化学方程式的书写,化学平衡常数的计算,化学平衡状态的判断以及有关电解质溶液的图像。
本题难度:困难
5、选择题 现有室温下的四种溶液,其pH如下表所示,下列有关叙述不正确的是
| ①
| ②
| ③
| ④
|
pH
| 11
| 11
| 3
| 3
|
溶液
| 氨水
| NaOH溶液
| 醋酸
| 盐酸
A.③④中分别加入适量醋酸钠晶体,两溶液pH均增大
B.②③两溶液等体积混合,所得溶液中:c(H+)>c(OH-)
C.分别加水稀释10倍,溶液的pH:①>②>④>③
D.V1L④和V2L①溶液混合后,若pH=7,则V1<V2
参考答案:D
本题解析:
试题分析:A、醋酸是一元弱酸,盐酸是一元强酸,向醋酸溶液中加入醋酸钠晶体抑制醋酸电离,pH增大。向盐酸中加入醋酸钠晶体,生成醋酸,氢离子浓度减小,pH增大,A正确;B、pH=3的醋酸溶液的浓度大于0.001mol/L,则②③两溶液等体积混合,醋酸过量溶液显酸性,则所得溶液中:c(H+)>c(OH-),B正确;C、弱电解质中存在电离平衡,稀释促进电离,因此分别加水稀释10倍,溶液的pH:①>②>④>③,C正确;D、V1L④和V2L①溶液混合后,若pH=7,说明反应后氨水稍过量,由于氨水的浓度高于盐酸,则V1>V2,D错误,答案选D。
考点:考查弱电解质的电离、pH以及溶液中离子浓度关系判断
本题难度:一般
|