微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应2SO2(g)+O2(g) 2SO3(g),下列判断正确的是
2SO3(g),下列判断正确的是
A.2 mol SO2和足量O2反应,必定生成2 mol SO3
B.该反应在容积不变的密闭容器中,若混合气的密度不变,说明达到平衡状态
C.平衡时,SO2消耗速率必定等于O2生成速率的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
参考答案:C
本题解析:
试题分析:A错误,反应2SO2(g)+O2(g) 2SO3(g)为可逆反应,其转换率不可能达到百分之百,所以2 mol SO2和足量O2反应,必定生成小于2 mol的 SO3;B错误,容积不变,则在反应的任何一个时候,包括没有达到平衡都是混合气的密度不变;C正确,D错误,没有说明各物质的量,所以SO2浓度不一定等于O2浓度的两倍。故答案为C。
2SO3(g)为可逆反应,其转换率不可能达到百分之百,所以2 mol SO2和足量O2反应,必定生成小于2 mol的 SO3;B错误,容积不变,则在反应的任何一个时候,包括没有达到平衡都是混合气的密度不变;C正确,D错误,没有说明各物质的量,所以SO2浓度不一定等于O2浓度的两倍。故答案为C。
点评:本题考查了化学平衡的基础知识,是高考考查的热点,本题难度适中。
本题难度:一般
2、选择题 物质的量之比为2∶3的N2和H2,在一定条件下反应,并达到平衡。在此过程中,下列说法正确的是(???)
A.在建立平衡的过程中,N2和H2的物质的量之比始终是2∶3
B.N2的转化率始终为H2转化率的2倍
C.N2的转化率始终为H2转化率的1/2
D.达到平衡时,平衡体系的总物质的量与起始时的总物质的量之比可为1∶2
参考答案:C
本题解析:设反应的N2物质的量为x。
由?????? N2 + 3H2 2NH3
2NH3
n(始)??2?????3????????0
n(变)??x?????3x??????2x
n(平)??2-x?3-3x??2x
A项应为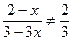 ?(因0<x<1),故不正确;B项应为
?(因0<x<1),故不正确;B项应为 ,故不正确;D项,用反证法,若D成立,则有
,故不正确;D项,用反证法,若D成立,则有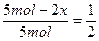 ,解得x=1.25 mol,则3x=3.75mol>3mol,故不可能,则D项不正确。应选C。
,解得x=1.25 mol,则3x=3.75mol>3mol,故不可能,则D项不正确。应选C。
本题难度:一般
3、选择题 一定温度下,将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2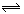 PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )
PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )
A.0.4mol
B.0.2mol
C.0.2<x<0.4mol
D.<0.2mol
参考答案:D
本题解析:若平衡时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,则相当于降低压强,平衡向逆反应方向进行,所以再次平衡时PCl5的物质的量小于0.2mol,答案选D。
本题难度:一般
4、选择题 已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)? ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g)? ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
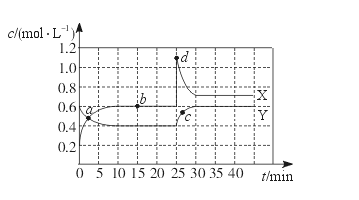
A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
参考答案:D
本题解析:反应是体积减小的,所以当压强不再发生变化时,可以说明反应已经达到平衡状态,A正确。根据图像可知,只与b点物质点浓度不再发生变化,所以b点是平衡状态,B正确。25~30 min内用NO2的浓度变化量是1.1mol/L-0.7mol/L=0.4mol/L,所以NO2的反应速率是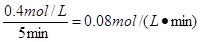 ,C正确。反应进行至25 min时,物质的浓度都是增大的,因此应该是增大压强,平衡向正反应方向移动,D不正确,答案选D。
,C正确。反应进行至25 min时,物质的浓度都是增大的,因此应该是增大压强,平衡向正反应方向移动,D不正确,答案选D。
本题难度:一般
5、简答题 【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示:
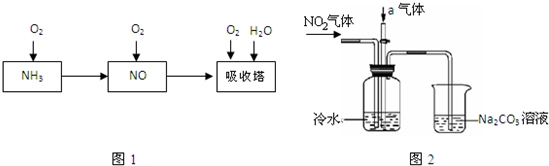
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是??????????????????;
(2)连接好装置后,首先进行的操作是????????????;
(3)通入a气体的目的是????????????;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是????????????。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是???????;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K=???,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为????。
N2O4(g)的平衡常数K=???,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为????。
参考答案:(1)4NH3+5O2 本题解析:(1)氨气的催化氧化反应方程式为:4NH3+5O2
本题解析:(1)氨气的催化氧化反应方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)连接好装置后先要检验装置的气密性,当装置气密性良好才能进一步进行实验。
(3)二氧化氮通入水中会生成硝酸和一氧化氮,再通氧气可以使一氧化氮转化为二氧化氮从而提高了NO2的转化率。
(4)根据元素守恒和得失电子守恒分析,2NO2和水反应生成硝酸,硝酸与碳酸钠反应生成硝酸钠和二氧化碳,其反应方程为2NO2+Na2CO3═NaNO2+NaNO3+CO2
(5)根据元素守恒和得失电子守恒分析,N2O4与水和氧气反应生成硝酸,反应方程式为:2N2O4+O2+2H2O=4HNO3
(6)根据平衡常数表达式计算,K= c(N2O4)/ c2(NO2)=1/2,设反应的NO2为xmol/L
2NO2(g) N2O4(g)
N2O4(g)
起始浓度:????? 2mol/L?????????? 0
反应浓度:??? x ?????? 1/2 x
平衡浓度:???2-x ??????1/2 x
 ? X=1??? NO2的最大转化率=1/2×100%=50%
? X=1??? NO2的最大转化率=1/2×100%=50%
本题难度:一般