微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将BaO2放入密闭的真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小
B.BaO量不变
C.氧气压强不变
D.BaO2量增加
参考答案:CD
本题解析:
试题分析:A.平衡常数只与温度有关,温度不变,平衡常数就不变。错误。B. 该反应的正反应是气体体积增大的反应。保持温度不变,缩小容器容积,也就增大了压强,根据平衡移动原理,化学平衡向气体体积减小的反应,即向逆反应方向移动,所以BaO量减小。错误。C.由于温度不变,化学平衡常数就不变,其数值就等于氧气的浓度,浓度不变,因此压强不变。正确。D. 缩小容器容积,平衡逆向移动,所以体系重新达到平衡BaO2量增加。正确。
本题难度:一般
2、填空题 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)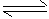 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
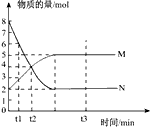
(1)此反应的化学方程式中a :b=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________
(3)下列叙述中能说明上述反应达到平衡状态的是_______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
参考答案:(1)a :b=2:1
(2) 1/(t2-t1)V
本题解析:
本题难度:一般
3、选择题 重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O  2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
A.NaHSO4
B.NaHCO3
C.Na2CO3
D.CH3COONa
参考答案:A
本题解析:
试题分析:溶液从黄色变为橙红色,反应逆向进行。A、HSO4–是二元强酸根离子在水溶液中水解能力较大HSO4-=H++SO42-,使溶液中H+浓度增大Cr2O72-(橙红色)+H2O  2H++2CrO42-(黄色)向逆反应方向进行,故溶液逐渐变为橙红色;B、HCO3-在溶液中不易水解HCO3-+H2O
2H++2CrO42-(黄色)向逆反应方向进行,故溶液逐渐变为橙红色;B、HCO3-在溶液中不易水解HCO3-+H2O H2CO3+OH-,H2O
H2CO3+OH-,H2O H++OH-;C、CO32-在水溶液中不易水解,溶液中CO32-+H2O
H++OH-;C、CO32-在水溶液中不易水解,溶液中CO32-+H2O  HCO3?+OH-,H++OH-?
HCO3?+OH-,H++OH-? H2O,反应正向进行;D、CH3COO-+H+
H2O,反应正向进行;D、CH3COO-+H+ CH3COOH,反应正向进行。
CH3COOH,反应正向进行。
本题难度:一般
4、选择题 在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应如下:2A(g)+B(g) 2D(g)??△H=-QKJ·mol-1。相关条件和数据见下表:
2D(g)??△H=-QKJ·mol-1。相关条件和数据见下表:
实验编号
| 实验Ⅰ
| 实验Ⅱ
| 实验Ⅲ
|
反应温度/℃
| 800
| 800
| 850
|
达平衡时间/min
| 40
| 10
| 30
|
c(D)平衡/mol·L-1
| 0.5
| 0.5
| 0.15
|
反应的能量变化/KJ
| Q1
| Q2
| Q3
下列说法正确的是
A.可用压强或密度是否发生变化判断上述反应是否达到平衡
B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol·L-1·min-1
C.由表中信息可知Q>O,并显有Q3<Q2=Q1=Q
D.实验Ⅰ达平衡后,恒温下再向容器中通入1molA和1molD,达平衡时c(D)为1.0mol·L-1。
参考答案:D
本题解析:
试题分析:A、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终不变,不能用密度来判断反应是否达到平衡状态,A不正确;B、实验Ⅱ中到达平衡的水解缩短,且平衡状态不变,因此可能隐含的条件是使用催化剂。实验Ⅲ达平衡时D的浓度是0.15mol/L,因此反应速率υ(D)=0.15mol/L÷30min=0.005mol·L-1·min-1,B不正确;C、升高温度D的浓度减小,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即Q>O。该反应是可逆反应,则Q3<Q2=Q1<Q,C不正确;D、实验Ⅰ平衡时A、D的浓度相同,加入1molA和1molD,二者的浓度仍然相等,平衡常数不变,达到与之前相同的平衡状态,所以D的浓度为1mol/L,故D正确。
本题难度:一般
5、选择题 密闭容器中,反应xA(g)+yB(g)  zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是?(???)?????????????????????????????????????????? zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是?(???)??????????????????????????????????????????
A.x+y>z
B.平衡向正方向移动
C.B的转化率降低
D.C的体积分数下降
参考答案:B
本题解析:
试题分析:保持温度不变,将容器的容积扩大到原来的2倍的瞬间, A的浓度降为0.25mol/L.但达新平衡时A的浓度变为0.3mol/L,这说明降低压强,平衡向逆反应方向移动,即正反应是体积减小的可逆反应,所以x+y>z,因此选项B不正确,其余选项都是正确的,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题针对性强,难易适中,注重答题的灵活性,有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是明确变化的瞬间与最终平衡时浓度的变化。
本题难度:简单
|