微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
 [???? ]
[???? ]
A.①分液,②过滤,③分馏,④重结晶都是混合物分离常用方法,其中根据粒子大小分离的只有②
B.欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
C.中和滴定时,滴定前滴定管必须洗净并烘干
D.可用上图装置干燥、贮存并吸收多余的HCl气体
2、简答题 中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:
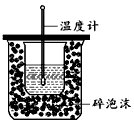
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:______,在大小烧杯之间填满碎泡沫(或纸条)其作用是______.
(2)该实验可用0.60mol?L-1HCl和0.65mol?L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是______.当室温低于10℃时进行,对实验结果会造成较大的误差其原因是______.
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g?℃),实验进行了三次,三次实验的△T平均为3.30℃,则该中和反应放出热量为______kJ(填表达式),△H=______kJ/mol(填表达式).
3、实验题 某实验小组用0.50?mol/L?NaOH溶液和0.50?mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50?mol/L?NaOH溶液
(1)若实验中大约要使用250?mL?NaOH溶液,至少需要称量NaOH固体__________g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):__________。

Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(3)某同学进行该实验时未找到环形玻璃棒,实验中他用铜丝代替环形玻璃棒进行搅拌,请说明此做法的缺点:___________________
(4)写出该反应的热化学方程式(中和热为57.3kJ·mol-1)_______________________
(5)取50?mL?NaOH溶液和30?mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:

②近似认为0.50?mol/L?NaOH溶液和0.50?mol/L硫酸溶液的密度都是1?g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
4、实验题 在下图所示的装置中进行中和反应的反应热测定,实验操作如下
① 用量筒量取50 mL 0.50 mol·L-1盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
② 把温度计上的酸用水冲洗干净。
③ 用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用温度计测量NaOH 溶液的温度,记入下表。
④ 把量筒中的NaOH溶液一次倒入盛有盐酸的小烧杯,轻轻搅拌,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤ 重复实验两次。
(1)实验数据处理(计算平均值)
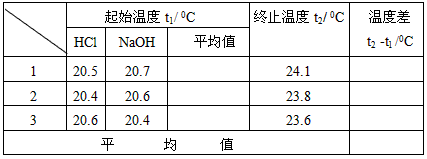
(2)计算反应热:为计算简便,视NaOH溶液和盐酸的密度和比热容与水相同,并忽略实验装置的比热容,近似认为上述NaOH溶液和盐酸溶液的质量各为50g;中和后溶液的比热容c = 4.18 J/(g·°C) 计算生成1mol水时的反应热△H =_______kJ·mol-1
(3)有关实验装置及实验操作方面的问题讨论:
①该实验装置缺少仪器名称是___________,用改正的装置进行实验并回答以下问题。
②如果改用60 mL 0.50 mol·L-1盐酸与60 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,计算生成1mol水放出的热________(填“偏大”“相等”“偏小”)。
③用相同浓度和体积的醋酸代替盐酸溶液进行上述实验,测得生成1mol水所放出的热________(填“偏大”“偏小”“无影响”)。
5、实验题 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________________。
(2)烧杯间填满碎纸条的作用是________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值______________。 (填“偏大.偏小.无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等.不相等”),所求中和热______(填“相等.不相等”)。简述理由________________________。