微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究小组将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。回答下列问题
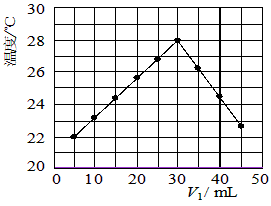
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22 ℃,判断的依据是____________________。
(2)由题干及图形可知,V1/V2=__________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为
__________mol/L。
(3)实验时将酸碱在简易量热计中混合,并用____________搅拌,使溶液混合均匀。经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式:__________________ 。
2、简答题 中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:______,在大小烧杯之间填满碎泡沫(或纸条)其作用是______.
(2)该实验可用0.60mol?L-1HCl和0.65mol?L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是______.当室温低于10℃时进行,对实验结果会造成较大的误差其原因是______.
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g?℃),实验进行了三次,三次实验的△T平均为3.30℃,则该中和反应放出热量为______kJ(填表达式),△H=______kJ/mol(填表达式).
3、实验题 某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·?L-1?盐酸、0.55mol·L-1 NaOH溶液,尚缺少的实验玻璃用品是__________、____________。
(2)他们记录的实验数据如下:

已知:Q=Cm(t2?-t1),反应后溶液的比热容C为4.18KJ·℃-1·Kg-1,各物质的密度均为1g·cm-3。计算完成上表。△H=____________
(3)某研究小组将V1?mL?1.0?mol/L?HCl溶液和V2?mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50?mL)。
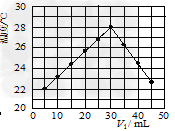
回答下列问题:研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22?℃,此反应所用NaOH溶液的浓度应为__________mol/L。
4、简答题 中和热的测定实验(如图).
①量取反应物时,取50mL0.50mol?L-1的盐酸,还应加入的试剂是______(填序号).
A.50mL0.50mol?L-1NaOH溶液
B.50mL0.55mol?L-1NaOH溶液
C.1.0gNaOH固体
②在该实验过程中,该同学需要测定的实验数据有______(填序号).
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL0.5mol?L-1醋酸溶液代替上述盐酸测定中和热,所得数据______.(填“偏大”或“偏小”或“不变”)
5、实验题 某实验小组设计用50?mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,试回答下列中和热测定中的有关问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、1.0mol/L盐酸、1.1mol/LNaOH溶液,尚缺少的实验仪器是______________。
(2)本实验中用稍过量的NaOH的原因是______________。
(3)碎泡沫塑料的作用是___________________________。?
(4)?在反应中若因为有放热现象,而造成少量HCl挥发,则测得的中和热数值________(填偏高、偏低或不变);
(5)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
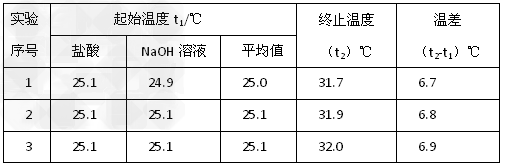
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容?C=4.18J/(g ℃),则该反应的中和热为△H=__________________(结果保留一位小数)。
℃),则该反应的中和热为△H=__________________(结果保留一位小数)。
(6)若用等浓度的醋酸代替盐酸与NaOH溶液反应,则测得的中和热的数值会_______(填偏高、偏低或不变),其原因_________________。