微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。

参考答案:
序号
实验步骤
简述实验操作(不必叙述如
本题解析:
试题分析:由于化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。所以要分离甲和乙的混合物,应该首先将混合物溶于浓硫酸中,然后通过过滤即可分离出乙。然后利用甲不溶于水,将滤液注入水中,将浓硫酸稀释,即可析出甲。
点评:该题是高考中的常见题型,属于中等难度的试题,侧重对学生利用已知信息解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性,有利于培养学生自学能力和知识的迁移能力。
本题难度:一般
2、选择题 15?g?A物质和10.5?g?B物质完全反应生成7.2?g?C物质和1.8?g?D物质和0.3?mol?E物质,E物质的摩尔质量为
A.100 g·mol-1
B.111 g·mol-1
C.55 g·mol-1
D.27.5 g·mol-1
参考答案:C
本题解析:根据质量守恒定律可知:m(A)+m(B)=m(C)+m(D)+m(E),所以m(E)="m(A)+m(B)-m(C)-m(D)=15+10.5-7.2-1.8=16.5" g,即E的摩尔质量为55 g·mol-1.
本题难度:困难
3、实验题 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
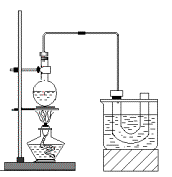
①检查装置的气密性,向装置图所示的U型管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小火加热,使其充分反应。
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为(生成的盐为NaHSO4):______________________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体化学式为__________。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
a.苯?????????? b.H2O????????? c.Na2SO3溶液??????????? d.CCl4
所需的主要玻璃仪器是______________(填仪器名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
参考答案:(11分)(1)C2H5OH+NaBr+H2SO4![]()
本题解析:
试题分析:(1)由题意可知,C4H9OH有四种同分异构体,C2H5OH+NaBr+H2SO4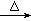 NaHSO4+C2H5Br+H2O;(2)若温度过高,浓硫酸将NaBr氧化为红棕色的Br2;(3)水浴加热能控制加热温度;(4)溴乙烷的沸点38.4℃,冷水浴可得到无色油状液体;(5)Br2易溶于C2H5Br、苯、CCl4,微溶于水,可以被Na2SO3溶液还原为Br—,故选c;充分反应后分液,用分液漏斗分离;(6)卤代烃在强碱溶液中加热时水解,冷却后加稀硝酸酸化,最后加硝酸银溶液可检验溴离子的存在,从而判断溴元素的存在。
NaHSO4+C2H5Br+H2O;(2)若温度过高,浓硫酸将NaBr氧化为红棕色的Br2;(3)水浴加热能控制加热温度;(4)溴乙烷的沸点38.4℃,冷水浴可得到无色油状液体;(5)Br2易溶于C2H5Br、苯、CCl4,微溶于水,可以被Na2SO3溶液还原为Br—,故选c;充分反应后分液,用分液漏斗分离;(6)卤代烃在强碱溶液中加热时水解,冷却后加稀硝酸酸化,最后加硝酸银溶液可检验溴离子的存在,从而判断溴元素的存在。
本题难度:一般
4、选择题 将下列物质的量浓度相等的溶液等体积两两混合有白色沉淀生成,加入过量的稀硝酸后,沉淀消失并放出气体,再加入硝酸银溶液又有白色沉淀生成的是
A.Na2CO3和Ca(OH)2
B.Na2CO3和CaCl2
C.Ca(HCO3)2和NaOH
D.Na2SO4和Ba(NO3)2
参考答案:B
本题解析:
试题分析:A、Na2CO3和Ca(OH)2等浓度等体积混合产生白色沉淀,Ca2++CO32-=CaCO3↓,加入过量硝酸发生反应,OH-+H+=H2O;CaCO3+2H+=CO2↑+H2O+Ca2+;再加入AgNO3溶液无白色沉淀生成,故A不符合;??? B、Na2CO3和CaCl2再加入AgNO3溶液,Ag++Cl-=AgCl↓,有白色沉淀生成,故B符合;?
C、Ca(HCO3)2和NaOH等浓度等体积混合产生白色沉淀,Ca2++HCO3-+OH-=CaCO3↓+H2O,加入过量硝酸发生反应,CaCO3+2H+=CO2↑+H2O+Ca2+,但是加入AgNO3溶液无白色沉淀产生;故C不符合;
D、Na2SO4和Ba(NO3)2等浓度等体积混合产生白色沉淀,Ba2++SO42-=BaSO4↓,加入过量硝酸不发生反应,无沉淀消失和气体生成,故D不符合;
点评:本题有一个突破点在于稀硝酸体系中出现沉淀,则可以排除A、C选项,再根据有气体生成可以得正确选项。
本题难度:简单
5、实验题 在6个集气瓶里分别盛有Cl2、N2、O2、CO2、NO2、NO等气体,试用最简单方法把它们鉴别出来。
答:__????????????????????????????????????????????????????????????????? __。
参考答案:观察颜色,呈黄绿色的气体为Cl2,呈红棕色气体为NO2;将剩
本题解析:氯气是黄绿色气体,二氧化氮是红棕色气体,可利用氯气和二氧化氮的颜色先鉴别出氯气和二氧化氮,NO遇空气迅速转变为红棕色;O2可使带余烬的木条复燃;CO2能使澄清的石灰水变浑浊,并能使燃着的木条熄灭;N2能使燃着的木条熄灭。利用这些特性可把剩余的四种气体区别开。
本题难度:一般