微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验设计方案中,可行的是( )
A.用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3
B.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D.仅用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液一次性鉴别出来
参考答案:A.铜比银活泼,可置换出银,以达到除去Cu(NO3)2溶液中
本题解析:
本题难度:一般
2、填空题 (6分)只需用一种试剂即可将酒精、苯酚溶液、四氯化碳、环己烯、甲苯五种无色液体区分开来,该试剂是____________(填序号)①FeCl3溶液②溴水③KMnO4溶液④金属钠其中所能发生化学反应的方程式为______________________。
参考答案:浓溴水???方程式略
本题解析:略
本题难度:一般
3、填空题 (12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
物质
| Cu(OH)2
| Fe(OH)3
| CuCl
| CuI
|
Ksp
| 2.2×10-20
| 2.6×10-39
| 1.7×10-7
| 1.3×10-12
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入???,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=??????。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是?????????(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是????????????。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用????????????作滴定指示剂,滴定终点的现象是????????????????????。
②CuCl2溶液与KI反应的离子方程式为?????????????????????????????????????。
③该试样中CuCl2·2H2O的质量百分数为????????????????。
参考答案:(12分)(1) CuO或Cu(OH)2或 CuCO3或Cu
本题解析:
试题分析:(1)由于在除杂的过程中不能引入新的杂质,所以要调节溶液的酸碱性,使氢氧化铁析出,而得到纯净的氯化铜晶体,则应该加入氧化铜或氢氧化铜。根据氢氧化铁的溶度积常数可知,当溶液的pH=4时,溶液中铁离子的浓度应该是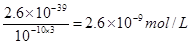 。 。
(2)由于氯化铜在溶液中存在铜离子的水解平衡,而加热促进水解,且生成的氯化氢极易挥发,进一步促进水解,因此得不到氯化铜晶体,反应的化学方程式使是2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。 Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。
(3)①由于碘离子被氧化生成了单质碘,而碘遇淀粉显蓝色,所以选择的指示剂是淀粉溶液。Na2S2O3将单质碘还原生成了碘离子,所以终点时的反应现象是蓝色褪去,放置一定时间后不复色。
②氯化铜能把碘化钾氧化生成单质碘,所以CuCl2溶液与KI反应的离子方程式是2Cu2++4I-===2CuI↓+I2。
③根据有关的反应方程式可知2CuCl2·2H2O~I2~2Na2S2O3,所以氯化铜晶体的物质的量是0.02L×0.1000mol/L=0.002mol,则试样中CuCl2·2H2O的质量百分数为 。 。
点评:本题是高考中的常见题型,属于难度较大的试题,考查的知识点比较多。这类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。本题有利于培养学生的逻辑推理能力,以及分析问题、解决问题的能力。
本题难度:一般
4、选择题 过滤时不需要的玻璃仪器是( ? ) A.烧杯
B.玻璃棒
C.漏斗
D.试管
参考答案:D
本题解析:
本题难度:简单
5、选择题 用括号内试剂除去下列各物质中的少量杂质,正确的是(????)
A.溴苯中的溴(KI溶液)
B.苯中的苯酚(溴水)
C.乙酸乙酯中的乙酸(饱和Na2CO3溶液)
D.苯中的甲苯(溴水)
参考答案:C
本题解析:略
本题难度:简单
|