微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:
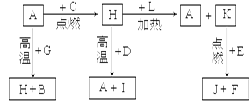
请回答下列问题:
(1)元素A在元素周期表中的位置为??????周期??????族。
(2)写出K的电子式?????????。
(3)写出H和D反应的化学方程式??????????????????。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式?????????????。
(5)写出A与G反应的化学方程式???????????????????????。
(6)K与E反应时产生的现象有????????????;该反应的化学方程式为????? ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
参考答案:(1)四;VIII ;(2) 本题解析:
本题解析:
试题分析:根据题意及物质间的转化关系可得:A是Fe;B是H2;C是O2;D是Al;E是Mg;F是C;G是H2O;H是Fe3O4;I是Al2O3;J是MgO;K是CO2;L是CO。(1)26号元素Fe在元素周期表中位于第四周期第VIII族;(2)CO2的电子式是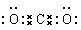 ;(3)Fe3O4和Al发生铝热反应的化学反
;(3)Fe3O4和Al发生铝热反应的化学反
本题难度:一般
2、选择题 有关氧化还原反应的下列叙述正确的是
A.氧化剂发生还原反应,还原剂发生氧化反应
B.氧化剂被氧化,还原剂被还原
C.在氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D.氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
参考答案:A
本题解析:
试题分析:A、氧化剂得到电子,发生还原反应。还原剂失去电子,发生氧化反应,A正确;B、氧化剂得到电子,被还原。还原剂失去电子,被氧化,B不正确;C、在氧化还原反应中,氧化剂和还原剂不一定是两种不同的物质,也可能是自身的氧化还原反应,例如氯气与氢氧化钠溶液的反应等,C不正确;D、氧化还原反应中,金属单质只作还原剂,非金属单质既可以作氧化剂,也可以作还原剂,D不正确,答案选A。
本题难度:一般
3、选择题 已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为
A.10mol
B.11mol
C.12mol
D.13mol
参考答案:B
本题解析:
试题分析:这是一个氧化还原反应,氧化剂所得到的电子数与还原剂所失去的电子数相等,每反应掉2mol的碘酸铜就反应掉24mol的碘化钾,其中作还原剂的碘化钾为22mol,共失去22mol的电子,那么有1mol的氧化剂参加反应时,所得到的电子就为11mol。选B
考点:考查氧化还原反应。
本题难度:一般
4、实验题 (16分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
参考答案:(1)2Fe3++H2S=Fe2++S↓+2H+(2分)使S
本题解析:
试题分析:(1)铁离子具有还原性,能氧化物H2S气体,反应的离子方程式为2Fe3++H2S=Fe2++S↓+2H+。SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,所以操作II,在溶液中用硫酸酸化至pH=2的目的是使Sn2+沉淀完全,防止Fe2+生成沉淀。
(2)从溶液中得到绿矾晶体的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(3)绿矾的溶解度随温度的升高而降低,所以用冰水洗涤的另一个目的是降低洗涤过程中FeSO4·7H2O的损耗。
(4)①滴定时眼睛注视锥形瓶中溶液颜色的变化;
②由于酸性高锰酸钾溶液显褐色,则滴定终点的实验现象是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
③由于亚铁离子易被氧化为铁离子,所以测定结果偏低。另外也可能是样品中含有杂质。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
5、实验题 (15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;

③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式
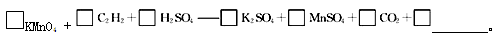
若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol ? L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
参考答案:(1)圆底烧瓶、分液漏斗、量筒(3分)
本题解析:
试题分析:(1)根据装置图可知上述实验所用的玻璃仪器有导管、水槽、圆底烧瓶、分液漏斗、量筒。
(2)1.2g碳化钙最多生成标准状况下乙炔的体积是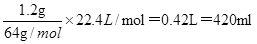 ,因此应选用500mL的量筒。
,因此应选用500mL的量筒。
(3)向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平。但由于作为反应器的烧瓶中有24 mL液体,则生成气体体积是360ml—24ml=336ml。由于气体的体积受温度和压强影响较大,所以为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是使量筒内外液面相平、视线与量筒内液面的最低处相切。
(4)乙炔中碳元素的化合价是—1价,反应后变为+4价,失去5个电子。高锰酸钾中锰元素的化合价从+7价降低到+2价,得到5个电子,则根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+C2H2+3H2SO4=K2SO4+2MnSO4+2CO2+4H2O。乙炔的物质的量是0.336L÷22.4L/mol=0.015mol,则根据方程式可知需要高锰酸钾是0.03mol,所以至少需0.1 mol ? L-1的KMnO4溶液的体积是0.03mol÷0.1mol/L=0.3L=300mL。
(5)根据碳原子守恒可知样品中CaC2的物质的量是0.015mol,则纯度为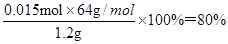 。
。
考点:考查电石含量测定实验方案设计与探究
本题难度:困难