微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 需要加入适当的氧化剂才能实现的反应
A.PCl3→PCl5
B.MnO4-→Mn2+
C.SO3→SO42-
D.CO2→CO32-
参考答案:A
本题解析:
试题分析:氧化剂在反应中得到电子,元素的化合价降低,因此如果变化需要加入适当的氧化剂才能完成,这说明选项中物质是还原剂,有关元素的化合价升高。A、转化PCl3→PCl5中P元素的化合价升高,需要加入氧化剂,A正确;B、转化MnO4-→Mn2+中Mn元素的化合价降低,需要加入还原剂,B不正确;C、转化SO3→SO42-中元素的化合价均没有变化,不需要加入氧化剂,C不正确;D.转化CO2→CO32-中元素的化合价均没有变化,不需要加入氧化剂,D不正确,答案选A。
本题难度:一般
2、选择题 金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为aTiO2+bCl2+cC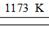 aTiCl4+cCO反应(1) TiCl4+2Mg
aTiCl4+cCO反应(1) TiCl4+2Mg Ti+2MgCl2反应(2)
Ti+2MgCl2反应(2)
关于反应(1)、(2)的分析不正确的是
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Mr=48),反应(1)、(2)中共转移4.8 mol e-。
A. ①②④ B. ②③④ C. ③④ D. ②⑤
参考答案:D
本题解析:
试题分析:①在反应(1)中氯元素的化合价降低,则TiCl4在反应(1)中是还原产物;在反应(2)中Ti的化合价从+4价降低到0价,是氧化剂,①正确;②C、Mg在反应中都失去电子,均为还原剂,被氧化,②错误;③在氧化还原反应中还原剂的还原性强于还原产物的还原性,则在反应(1)、(2)中的还原性C>TiCl4、Mg>Ti,③正确;④根据原子守恒和电子得失守恒可知在反应(1)中a=1,b=c=2,④正确;⑤19.2gTi的物质的量是19.2g÷48g/mol=0.4mol,根据反应式(2)可知转移电子的物质的量是0.4mol×4=1.6mol。生成0.4mol TiCl4相应消耗0.8mol氯气,则反应(1)中转移0.8mol×2=1.6mol电子,所以每生成19.2 g Ti(Mr=48),反应(1)、(2)中共转移3.2mol e-,⑤错误,答案选D。
考点:考查氧化还原反应的有关判断与计算
本题难度:一般
3、计算题 (6分)用MnO2和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则
(1)制氯气的反应中转移了多少个电子?
(2)生成多少升氯气?
可制得漂白粉多少克?
参考答案:(1)2.048×1023
本题解析:
试题解析:(1)MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为2.048×1023个;(2)在MnO2+4HCl(浓)
MnCl2+Cl2+2H2O↑,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为2.048×1023个;(2)在MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;
MnCl2+Cl2+2H2O↑反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
则所得漂白粉的质量为11.1g+14.3g=25.4g。
考点:电子转移数目、化学方程式的计算
本题难度:一般
4、简答题 过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分氧化钙.
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2(CaO2-xH2O)
△
2CaO+O2↑+2xH2O,得到的O2在标准状况下体积为67.2ml.该样品中CaO2的物质的量为______.
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3?0.70g.
①试计算样品中CaO的质量.
②试计算样品中CaO2-xH2O的x值.
参考答案:(1)n(O2)=
本题解析:
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.11.2L NO和11.2L O2混合后的分子总数为NA
B.1mol苯乙烯中含有的碳碳双键数为4NA
C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D.1mol Fe与足量的稀HNO3反应并放出NO和N2O,转移3 NA个电子
参考答案:D
本题解析:
试题分析:A、NO与氧气混合发生反应2NO+O2=2NO2,反应是体积减小的可逆反应,因此11.2L NO和11.2L O2混合后的分子总数小于NA,另外气体的状态也不一定是在标准状况下,A不正确;B、苯环分子中不存在碳碳双键,因此1mol苯乙烯中含有的碳碳双键数为NA,B不正确;C、 91exam .org浓硫酸与铜反应随着反应的进行浓度降低,稀硫酸与铜不反应,所以50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目小于0.46NA,C不正确;D、铁与足量的稀硝酸反应生成硝酸铁,转移3个电子,因此1m
本题难度:简单