微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水就能鉴别的一组物质是
A.苯乙醇四氯化碳
B.乙醇乙醛乙酸
C.乙醛乙二醇硝基苯
D.苯酚乙醇甘油
参考答案:A
本题解析:
本题难度:一般
2、选择题 根据以下实验的检验所得出的结论可靠的是
A.常温下测得等物质的量浓度碳酸的pH大于盐酸的pH,所以碳元素比氯元素的非金属性弱
B.向无色溶液通入Cl2?后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I-
C.向溴苯中加入稀氢氧化钠并加热,冷却后取出少量溶液于小试管中,加入稀AgNO3溶液,未发现有浅黄色沉淀生成,由此确定溴苯还未水解
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀盐酸,沉淀不消失,由此确定该溶液中一定含有SO42-
参考答案:B
本题解析:分析:A.利用最高价氧化物水化物的酸性比较非金属性;
B.碘单质遇淀粉变蓝;
C.检验溴离子应在酸性条件下;
D.AgCl也不溶于水不溶于酸.
解答:A.利用最高价氧化物水化物的酸性比较非金属性,盐酸为无氧酸,则不能利用酸性比较非金属性,故A错误;
B.碘单质遇淀粉变蓝,则向无色溶液通入Cl2?后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I-,故B正确;
C.向溴苯中加入稀氢氧化钠并加热,冷却后取出少量溶液于小试管中,加硝酸至酸性,再加入稀AgNO3溶液检验溴离子,故C错误;
D.AgCl也不溶于水不溶于酸,则向无色溶液加BaCl2溶液,生成白色沉淀,再加稀盐酸,沉淀不消失,由此确定该溶液中可能含有SO42-,还可能为Ag+,故D错误;
故选B.
点评:本题考查物质的检验及鉴别,侧重物质性质的考查,涉及非金属性的比较、离子的检验、水解等,注重基础知识的考查,选项C为解答的易错点,题目难度不大.
本题难度:困难
3、选择题 下列说法正确的是
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1∶1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
参考答案:C
本题解析:乙醇和水互溶,不能作为萃取碘水中的萃取剂,A不正确。B不正确。氯化钠是离子晶体,破坏的是离子键。碳化硅是原子晶体,破坏的是极性键。D不正确,硫化氢中的氢元素是2电子稳定结构,所以正确的答案选C。
本题难度:一般
4、选择题 能正确表示下列化学反应的离子方程式的是
A.氢氧化钡溶液与硫酸铜的反应2OH-+Cu2+=Cu(OH)2↓
B.碳酸氢钠与稀盐酸反应CO32-+2H+=CO2↑+H2O
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2↑
参考答案:D
本题解析:分析:A.氢氧化钡溶液与硫酸铜的反应生成Cu(OH)2和BaSO4;
B.碳酸氢钠为NaHCO3;
C.从电荷是否守恒的角度分析;
D.碳酸钙不溶于水,与盐酸反应生成CO2和CaCl2.
解答:A.氢氧化钡溶液与硫酸铜的反应生成Cu(OH)2和BaSO4,反应的离子方程式为Ba2++SO42-+2OH-+Cu2+=BaSO4↓+Cu(OH)2↓,故A错误;
B.碳酸氢钠为NaHCO3,反应的离子方程式为HCO3-+H+=CO2↑+H2O,故B错误;
C.电荷不守恒,反应的离子方程式应为Cu+2Ag+=Cu2++2Ag,故C错误;
D.碳酸钙不溶于水,与盐酸反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故D正确.
故选D.
点评:本题考查离子方程式的书写,题目难度中等,解答本题时注意离子方程式的书写必须符合反应的实际,注意物质化学式的书写.
本题难度:困难
5、选择题 下图所示为某晶体的一个晶胞,该晶体由A、B、C三种基本粒子组成。试根据晶胞判断,该晶体的化学式为
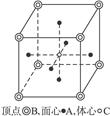
A.A6B8C
B.A2B4C
C.A3BC
D.A3B4C
参考答案:C
本题解析:观察题中该晶胞的结构,可知处于立方体顶点上的每个B粒子为8个相邻的立方体所共有,因此属于一个晶胞的B粒子共有:8× =1个。排在面心上的6个A粒子,每个为相邻的2个立方体所共有,因此属于一个晶胞的A为:6×
=1个。排在面心上的6个A粒子,每个为相邻的2个立方体所共有,因此属于一个晶胞的A为:6× =3个。位于立方体体心的C粒子,为单个晶胞所拥有。故每个立方体拥有3个A粒子、1个B粒子、1个C粒子,即该晶体的化学式为A3BC。
=3个。位于立方体体心的C粒子,为单个晶胞所拥有。故每个立方体拥有3个A粒子、1个B粒子、1个C粒子,即该晶体的化学式为A3BC。
本题难度:困难