微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将7.8gMg?Al合金溶于120ml?4mol/L?H2SO4中,当合金完全溶解后,再加入120ml?8mol/L的NaOH溶液,得到沉淀的质量为21.4g,则加入H2SO4时产生的氢气的物质的量为
A.0.4mol
B.0.6mol
C.0.8mol
D.1.0mol
参考答案:A
本题解析:分析:该溶液中始没有反应的离子是硫酸根离子和钠离子,溶液中硫酸根离子的物质的量为0.12L×4mol/L=0.48mol,硫酸根所带电荷为0.48mol×2=0.96mol;溶液中钠离子的物质的量0.12L×8mol/L=0.96mol,钠离子所带电荷为0.96mol×1=0.96mol;钠离子和硫酸根离子所带电荷相等,所以该溶液的溶质有硫酸钠.淀为氢氧化镁、氢氧化铝沉淀,铝元素全部以氢氧化铝形式存在.计算沉淀中氢氧根的质量,进而计算氢氧根的物质的量,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根的物质的量,再根据电子转移守恒,计算生成的氢气.
解答:溶液中硫酸根离子的物质的量为0.12L×4mol/L=0.48mol,硫酸根所带电荷为0.48mol×2=0.96mol;
溶液中钠离子的物质的量0.12L×8mol/L=0.96mol,钠离子所带电荷为0.96mol×1=0.96mol;
钠离子和硫酸根离子所带电荷相等,所以该溶液的溶质有硫酸钠.
所以沉淀为氢氧化镁、氢氧化铝沉淀,铝元素全部以氢氧化铝形式存在.
沉淀中氢氧根的质量为21.4g-7.8g=13.6g,氢氧根的物质的量为 =0.8mol;
=0.8mol;
根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根的物质的量为0.8mol,
根据电子转移守恒,生成的氢气n(H2)= =0.4mol.
=0.4mol.
故选A.
点评:本题考查了镁铝及其化合物的性质、混合计算,关键判断沉淀的成分,即确定铝元素的存在形式,采用常规法解题,有关的反应方程式较多计算量大,不易解出答案;本题用溶液中阴阳离子所带电荷相等,判断溶质的成分,进而判断沉淀成分,再根据守恒计算.
本题难度:困难
2、选择题 香烟烟雾中含有CO、CO2、SO2、H2O等气体.用a.无水硫酸铜、b.澄清石灰水、c.红热氧化铜、d.生石灰、e.酸性品红溶液等可将其一一检出,检出的正确顺序是
A.混合气→a→e→b→a→d→c
B.混合气→c→d→e→e→a
C.混合气→a→e→e→b→d→c
D.混合气→b→e→a→d→c
参考答案:C
本题解析:检验气体时,必须注意前面实验不能干扰后续实验,确定好检验顺序.特别注意:先检验SO2气体的存在(因SO2也能使澄清石灰水变浑浊),再验证SO2是否除净.
本题难度:简单
3、选择题 0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的物质的量浓度之比为
A.5:2
B.3:1
C.15:2
D.5:2
参考答案:B
本题解析:试题分析:浓度与体积无关。两溶液中Cl-浓度比为1×3:1×1。
考点:物质的量浓度计算
点评:浓度与体积无关。
本题难度:困难
4、选择题 38.4mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到体积22.4mL(标况),反应消耗的硝酸的物质的量可能是
A.1.0×10-3mol
B.1.6×10-3mol
C.2.2×10-3mol
D.2.4×10-3mol
参考答案:C
本题解析:
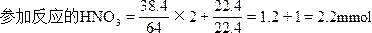
本题难度:简单
5、选择题 过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2.当0.2mol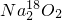 与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是
与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:Na218O2与CO2的反应实质是-1价的氧发生歧化反应,发生2Na218O2+2CO2═2Na2CO3+18O2,以此解答该题.
解答:Na218O2与CO2的反应实质是-1价的氧发生歧化反应,发生2Na218O2+2CO2═2Na2CO3+18O2,其中生成物Na2CO3中有1个18O为,摩尔质量为108g/mol,氧气为18O2,摩尔质量是36g?mol-1,则当0.2molNa218O2与足量CO2完全反应后,生成Na2CO3的质量为21.6g,生成标准状况下O2的体积为2.24L,
故选B.
点评:本题考查钠的重要化合物,题目难度不大,注意把握反应的原理,为解答该题的关键.
本题难度:简单