微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:

用电石浆可生产无水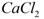 ,某化工厂设计了以下工艺流程:
,某化工厂设计了以下工艺流程:
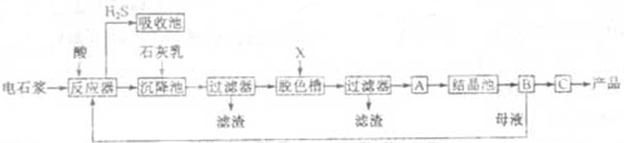
已知氯化钙晶体的化学式是: 是一种酸性气体,且具有还原性。
是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用 ????。
(2)脱色槽中应加入的物质X是???;设备A的作用是??;设备B的名称为 ?④ ?;设备C的作用是 ??⑤?。
(3)为了满足环保要求,需将废气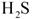 通入吸收池,下列物质中最适合作为吸收剂的是?⑥?。
通入吸收池,下列物质中最适合作为吸收剂的是?⑥?。
A.水
B.浓硫酸
C.石灰乳
D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是?⑦?????。
参考答案:①盐酸
②活性炭
③蒸发浓缩
④
本题解析:实验目的是用电石浆可生产无水CaCl2。所以在反应器中加的酸必为盐酸,此时反应器中是CaCl2、AlCl3、FeCl3、MgCl2溶液,加石灰乳将产生沉淀,氢氧化铁、氢氧化铝、氢氧化镁,过滤除去铁元素、镁元素、铝元素;过滤后所得溶液主要为氯化钙溶液,再经过脱色、过滤处理得到氯化钙溶液,经过蒸发结晶、过滤、脱水干燥得到无水氯化钙产品。
(1)实验目的是用电石浆可生产无水CaCl2。所以在反应器中加的酸必为盐酸;
(2)加活性炭进行脱色处理,过滤处理得到氯化钙溶液,经过蒸发结晶、过滤、脱水干燥得到无水氯化钙产品。
(3)硫化氢气体用碱液吸收,环保,同时石灰乳易得、经济。
(4)将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益;
本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握。
本题难度:一般
2、实验题
①电解池中电极反应的方程式是
阴极:??????????????????????,阳极:??????????????????????。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目???????????????????。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是?????????????????????????????????,该反应能够进行的原因是?????????????????????????????????????????????????????????。
④已知下列各物质的价格如下表:
物质
| NaCl
| KCl
| NaClO3
| KClO3
| KOH
|
价格(元/50kg)
| 500
| 1900
| 4200
| 26000
| 10600
从经济效益分析,上述方法中的第?????种方法更好,理由是????????????????????????
?????????????????????????????????????????????????????????????????????????????。
参考答案:① 2H++2e—==H2↑(1分),2Cl——2e—="=
本题解析:①由离子的放电顺序知,氢离子比钾离子易放电,氯离子比氢氧根离子易放电,故阴极是氢离子放电,阳极是氯离子放电,电极反应式为,阴极: 2H++2e—==H2↑
阳极:2Cl——2e—="=" Cl 2↑
②电解生成了氢气、氯气、氢氧化钾,要得到氯酸钾,很明显是氯气与氢氧化钾在加热条件下反应得到的,故其离子反应式及电子转移的方向和数目为: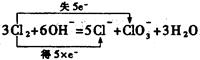
③电解氯化钠溶液与电解氯化钾溶液的电极反应是一样的,即电解后得到氯酸钠溶液,氯酸钠再与等物质的量氯化钾反应生成氯酸钾,而另一产物必然是氯化钠,反应方程式为:NaClO3+KCl==KClO3+NaCl,该反应为一个复分解反应,之所以可以向生成氯酸钾的方向进行只能是氯酸的溶解度小,可以从溶液中析出,从而降低溶液中钾离子和氯酸根离子的浓度。
④从价格上明显可以看出氯化钾比氯化钠的价格要高得多,而第一种方法氯化钾的利用率只有1/6,第二种方法氯化钾的利用率为100%,故第二种方法更好,理由是第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。
本题难度:一般
3、选择题 拟用下图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中不能达到目的的是
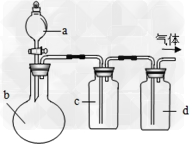 [???? ] [???? ]
制取气体??
a
b
c
d
A.
NO??
稀硝酸
铜片
H2O
浓硫酸
B.
O2??
双氧水
MnO2
H2O
浓硫酸
C.
NH3???
浓氨水
碱石灰
浓硫酸
H2O
D.
SO2???
浓盐酸
Na2SO3粉末
NaHSO3溶液
浓硫酸
参考答案:C
本题解析:
本题难度:简单
4、填空题 资料显示:“氨气可在纯氧中安静燃烧,其燃烧产物对环境没有污染。”
某学校化学小组的学生设计如图装置(图中铁夹等夹持装置已略去),进行氨气与氧气在不同条件下反应的实验。
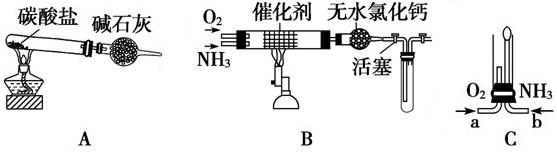
(1) 用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是????????????????????;
碱石灰的作用是????????????????????????????????????;
(2) 将产生的氨气与过量的氧气通到装置B (催化剂为铂石棉)中,用酒精喷灯加热,
氨催化氧化的化学方程式是?????????????????????????????????????????????????;
试管内气体变为红棕色,该反应的化学方程式是???????????????????????????????;
(3) 将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端
点燃氨气,氨气在纯氧中燃烧的化学方程式是?????????????????????????????????。
参考答案:
(1)? (NH4)2CO3?(填NH4HCO3给1
本题解析:
试题分析:(1)A装置中制备铵氨气,需要铵盐,所以应该为碳酸铵固体。碱石灰的作用是吸收碳酸铵分解后的水和二氧化碳。(2)氨气催化氧化生成一氧化氮和水。气体变为红棕色说明生成了二氧化氮(3)如果在纯氧气中燃烧,则生成的产物是氮气和水。
点评:本题涉及到了氨气的化学性质,在制备氨气的过程中利用了固体铵盐加热分解的性质,此套装置需要学生熟练掌握。氨气的催化氧化中需要注意方程式的书写,以及产物的性质。
本题难度:一般
5、填空题 (14分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要?????????????????
(2)用???????????????量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
实验次数
| 第一次
| 第二次
| 第三次
| 消耗盐酸溶液体积/mL
| 19.00
| 23.00
| 23.04
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛???? ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有??_____
A. 配制标准溶液定容时,加水超过刻度????? B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。
参考答案:(1)100 mL容量瓶(写容量瓶1分)
(2)碱式滴
本题解析:(1)准确配制一定物质的量浓度的溶液所需要的仪器还缺少100 mL容量瓶。
(2)氢氧化钠是强碱,应该用碱式滴定管。根据数据可知,第一次实验的数据是无效的,所以取后2次的平均值为23.02ml。因此NaOH溶液的浓度为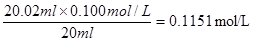
(3)滴定时边滴边摇动锥形瓶,眼睛要始终注视锥形瓶内溶液颜色的变化。
(4)A相当于盐酸的浓度偏低,消耗盐酸的体积就偏大,所以结果偏高。B符合要求,不影响。C也是相当于降低了盐酸的浓度,结果偏高。俯视读出滴定管读数,则读数偏低,则消耗盐酸的体积偏低,测得结果偏低。E中相当于盐酸的体积偏大,结果偏高。F中相当于减少了氢氧化钠的量,消耗盐酸的体积偏低,结果就偏低。
(5)临近终点时pH还会发生突变,如图
(6)碘遇淀粉显蓝色,所以可选择淀粉作指示剂。高锰酸钾溶液具有强氧化性,应该用酸式滴定管。
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772