微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会(??? )。
A.偏低l%
B.偏高1%
C.无影响
D.偏高0.1%
参考答案:C
本题解析:因为不论是氢氧化钠还是碳酸钠和盐酸反应的最终产物都是氯化钠,虽然碳酸钠还生成二氧化碳,但由于甲基橙的变色范围是3.1~4.4,所以根据钠离子守恒可知,消耗的盐酸是相同的,因此对测定结果是无影响的。答案选C
本题难度:简单
2、选择题 下列关于实验室制取乙烯的实验,其中说法正确的是(???)
A.乙醇和浓硫酸体积比为3∶1
B.温度计应插入反应物液体中
C.加热混合液至140℃左右
D.向浓硫酸中注入乙醇
参考答案:B
本题解析:略
本题难度:简单
3、实验题 下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
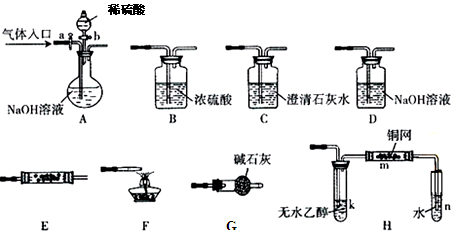
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
参考答案:(1)ACBECF(2分)?? AB之间的C装置中溶液保持澄
本题解析:
试题分析:(1)用A装置的NaOH来除CO中混有的CO2,(生成Na2CO3),用C装置检验有没有除尽CO2,B装置是干燥气体的,纯净的CO,通入E中,生成的CO2能使装置C有沉淀,多余的CO在装置F处尾气吸收。
(2)关闭装置A的活塞a,停止通入CO和CO2,打开活塞b,使稀硫酸和A中的碳酸钠反应,产生CO2,通入E,和Na2O2,产生O2,用D吸收O2混有的CO2,用B干燥O2中的H2O,纯净的O2在H中和乙醇发生催化氧化反应。加热k产生乙醇蒸汽,加热m ,是因为乙醇催化氧化需要催化剂铜和加热条件。
(3)这过程发生的反应为4NH3+5O2=4NO+6H2O(NH3表现还原性);2NO+O2=2NO2(红棕色)。
本题难度:一般
4、实验题 (14分)现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
HCOOH
?
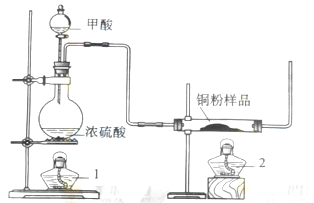 .(1)制备一氧化碳的化学方程式是???????????????????????; .(1)制备一氧化碳的化学方程式是???????????????????????;
(2)实验中,观察到反应管中发生的现象时???????????????????????;尾气的主要成分是???????????????????????;
(3)反应完成后,正确的操作顺序为???????????????????????(填字母)
a.关闭漏斗开关????? b.熄灭酒精1???? c.熄灭酒精灯2
(4)若实验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为?????????????????????????????;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)???????????????????????????? _________________________________________________________;
②写出有关反应的化学方程式?????????????????????????????????????????。
参考答案:(14分)
(1) 本题解析: 本题解析:
试题分析:首先要明确实验目的:制取一氧化碳,测定铜的含量,围绕这一实验目的展开装置、仪器、操作、数据处理等分析。
(1)利用图中所示装置制取CO,并用以测定某铜粉样品中金属铜的含量。装置左边图是制取CO的,反应物为HCOOH和浓硫酸,注意浓硫酸在此做催化剂和脱水剂,HCOOH脱水得到CO;
(2)右边反应管中有黑色CuO和CO反应生成红色的铜单质;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作的原因是防止空气中O2进入右边装置铜又被氧化为氧化铜了;
(4)由氧化铜变为铜产生质量差,可计算铜粉样品5.0g中的铜为4.0g,
则原样品中单质铜的质量分数为4.0÷5.0==80%;
(5)用所给试剂,设计一个测定样品中金属铜质量分数的方案,可用硫酸反应掉氧化铜,过滤称取铜的质量即可。所以操作过程为将浓硫酸稀释,称取一定量的样品,样品与过量稀硫酸充分反应,过滤、洗涤、干燥、称量、计算。
点评:实验题的分析思路:先要明确实验目的,然后再分析实验原理、装置的作用,试剂的选择、数据的处理、现象与数据对结论的关系。
本题难度:一般
5、选择题 美国宇航局科学家2010年3月1日说,美国雷达发现,月球北极40多个陨石坑含有6亿吨水冰。对下列实验指定容器中的水,其解释没有体现水的主要作用的是[???? ]
实验装置
解释
A.
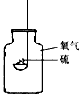
硫在氧气中燃烧
集气瓶中的水:吸收放出的热量
B.

测定空气中氧气含量
量筒中的水:通过水体积的变化测出氧气体积
C.

铁丝在氧气中燃烧
集气瓶中的水:冷却溅落熔融物,防止集气瓶炸裂
D.

排水法收集氢气
集气瓶中的水:水先将集气瓶中的空气排尽,后便于观察氢气何时收集满
参考答案:A
本题解析:
本题难度:简单
|
网站客服QQ: 960335752 - 14613519 - 791315772